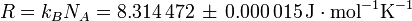Constante de Avogadro
Fundo para as escolas Wikipédia
Crianças SOS produziu este website para as escolas, bem como este site de vídeo sobre a África . Visite o site da SOS Children at http://www.soschildren.org/
A constante de Avogadro (símbolos: L, N) A, também chamado o número de Avogadro é o número de "entidades" (normalmente, os átomos ou moléculas) num molar, isto é, o número de carbono-12 átomos em 12 gramas (0,012 kg ) de desvinculado de carbono-12 em seu estado fundamental. A atual melhor estimativa desse número é:
O valor do número foi indicado em primeiro lugar pela Johann Josef Loschmidt, que em 1865, calculado o número de partículas de um centímetro cúbico de gás em condições padrão. O termo Loschmidt constante é, assim, mais correctamente aplicado para este último valor, o que pode ser dito para ser proporcional ao número de Avogadro. No entanto, em língua alemã literatura, "Loschmidt constante" é utilizado para se referir a ambos este uso, assim como o número de entidades em uma toupeira.
História e etimologia
A constante de Avogadro é nomeado após o início do século XIX italiano cientista Amedeo Avogadro, que é creditado (1811) como sendo o primeiro a perceber que o volume de um gás (estritamente, de uma dos gases ideais) é proporcional ao número de átomos ou moléculas . O químico francês Jean Baptiste Perrin em 1909 propôs nomear o constante em honra de Avogadro. Livros de química americanos apanhou-o em 1930, seguido de livros didáticos do ensino médio a partir na década de 1950.
Loschmidt: Medindo o número de Avogadro
Avogadro nunca tentou para medir a constante: o valor numérico foi estimada pela primeira vez pelo austríaco físico Johann Josef Loschmidt em 1865 usando o teoria cinética dos gases. Nos países de língua alemã, a constante é por vezes referido como o Loschmidt constante ou número de Loschmidt, mas que, na verdade, Loschmidt medido é o número de partículas por unidade de volume de uma gás ideal, ou seja, o densidade número de partículas em um gás ideal. Assim, a constante de Loschmidt termo é mais apropriado para o número de partículas por unidade de gás, o símbolo: N O:
igual a (2,686 ± 7,774 0,000 0,047) × 10 25 m -3 a 273,15 K e 101,325 kPa com k B a Constante de Boltzmann, T a temperatura e a p pressão.
Esta constante está relacionada com a constante de Avogadro pela relação:
com k B a Constante de Boltzmann, e R a constante de gás, daí
No entanto, em alemão literatura científica, a constante Loschmidt termo é usado de forma ambígua - que muitas vezes se refere ao que veio a ser conhecido como número de Avogadro. No entanto, Boltzmann tinha usado pela primeira vez o termo para o sentido em que Loschmidt tinha medido lo - o número de partículas em uma unidade de volume de gás. Assim, a sua utilização em referindo-se ao número de Avogadro relacionadas leva à confusão e normalmente é depreciado. Pela mesma razão, por vezes o número de Avogadro é denotado como L, em oposição a N A em textos alemães.
Padronização da toupeira
Antes de 1960, havia conflitantes definições do toupeira, e, consequentemente, do número de Avogadro (como era conhecido na época), com base em 16 gramas de oxigênio: físicos geralmente utilizados oxigênio-16, enquanto os químicos geralmente utilizados a "ocorrência natural" razão isotópica.
Switching, em 1960, para 12 gramas de carbono-12 como base terminou esta disputa e teve outras vantagens. Neste momento, o número de Avogadro foi definida como o número de átomos em 12 gramas de carbono-12, que é como um quantidade adimensional, enquanto que uma toupeira foi definida como um número de Avogadro de átomos, moléculas ou outras entidades.
Quando o número de moles entrou no Sistema Internacional de Unidades (SI), em 1971, as definições foram trocados.
Em 1971, uma toupeira foi definida como o número de átomos em 12 gramas de carbono-12, com a sua própria dimensão, ou seja, "quantidade de substância". O número de Avogadro tornou-se um constante física com a unidade de moles recíprocos (mol -1).
Aplicação
A constante de Avogadro pode ser aplicado a qualquer substância. Ele corresponde ao número de átomos ou moléculas necessárias para realizar uma massa igual à substância de atômica ou molecular em massa , em gramas. Por exemplo, a massa atómica do ferro é 55,847 g / mol, de modo que N, um átomos de ferro (ou seja, uma mole de átomos de ferro) tem uma massa de 55,847 g. Por outro lado, 55,847 g de ferro contém N A átomos de ferro. A constante de Avogadro também entra na definição do unificada unidade de massa atômica, u:
Relações físicas adicionais
Por causa de seu papel como um fator de escala, o número de Avogadro fornece a ligação entre um número de constantes físicas úteis quando se deslocam entre a escala atômica e escala macroscópica. Por exemplo, fornece a relação entre:
- o R e gás constante a Constante de Boltzmann k B:
- em J mol -1 K -1
- o Faraday F e a constante elementar carga e:
- em C mol -1
A medição da constante de Avogadro

Um número de métodos pode ser utilizado para medir a constante de Avogadro. Um método moderno é para calcular a constante de Avogadro da densidade (ρ) de um cristal, a massa atómica relativa (M), e o comprimento da célula unitária (a) determinada a partir de A cristalografia de raios-x. Valores muito precisos destas quantidades de silício foram medidos no Instituto Nacional de Padrões e Tecnologia (NIST) e usado para obter o valor da constante de Avogadro:
 .
.
- com base em silício.