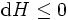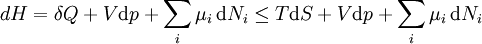Entalpia
Você sabia ...
Crianças SOS, uma instituição de caridade educação , organizou esta seleção. Clique aqui para saber mais sobre apadrinhamento de crianças.
| Mecânica estatística |
|---|
 |
|
Estatísticas de partículas
|
Ensembles
|
|
Modelos
|
Potenciais
|
Em termodinâmica e química molecular , a entalpia ou calor conteúdo (denotado como H, 'h', ou raramente como χ) é um quociente ou a descrição de potencial termodinâmico de um sistema, que pode ser usado para calcular o trabalho "útil" obtida a partir de um fechado sistema termodinâmico sob pressão constante.
O termo entalpia é composto do prefixo en-, significando "colocar em" eo grego palavra -thalpein, que significa "Heat", embora a definição original é pensado para ter originado da palavra, "enthalpos" (ἐνθάλπος). Muitas vezes, é calculada como uma soma diferencial, descrevendo as mudanças dentro e exo endo térmicas reações, que minimizam em equilíbrio.
História
Sobre o história da termodinâmica, vários termos têm sido utilizados para indicar o que é agora conhecida como a entalpia de um sistema. Originalmente, pensou-se que a palavra "entalpia" foi criado pela Benoit Paul Émile Clapeyron e Rudolf Clausius através da publicação do Clausius-Clapeyron relação em "As Tabelas de Vapor Mollier e diagramas" em 1827 , mas foi mais tarde publicado que a gravação mais antiga da palavra foi em 1875 , por Josiah Willard Gibbs na publicação "Físico-Química: uma Treatise Avançado", embora não é referenciado em Gibbs 'trabalha diretamente. Em 1909 , Keith Landler discutido "trabalho sobre a« Gibbs função de calor para a pressão constante "e observou que Heike Kamerlingh Onnes tinha cunhou seu nome moderno do grego palavra "enthalpos" (ενθαλπος) que significa "pôr em calor."
Definição original
Esta é a mudança de calor que ocorre quando uma mole de uma substância reage completamente com o oxigénio para formar produtos a 298 K e 1 atm. A função H foi introduzido pelo físico holandês Heike Kamerlingh Onnes no início do século 20 na seguinte forma:
em que E representa a energia do sistema. Na ausência de um campo externo, a entalpia pode ser definido, como é geralmente conhecido, por:
onde (todas as unidades de dados em SI)
- H é a entalpia ( joules)
- U é a energia interna, (joules)
- p é a pressão do sistema, ( pascal)
- V é o volume de , ( metros cúbicos)
Aplicação e fórmula estendida
Visão global
Em termos de termodinâmica, entalpia pode ser calculada através da determinação dos requisitos para a criação de um sistema de "nada"; o trabalho mecânico necessário, 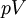 difere, com base na constância das condições presentes na criação do sistema termodinâmico.
difere, com base na constância das condições presentes na criação do sistema termodinâmico.
Energia interna,  , Deve ser fornecido para remover partículas de um torno, de modo a deixar espaço para a criação de um sistema, desde que as variáveis ambientais, tais como a pressão (
, Deve ser fornecido para remover partículas de um torno, de modo a deixar espaço para a criação de um sistema, desde que as variáveis ambientais, tais como a pressão (  ) Permanece constante. Esta energia interna inclui também a energia necessária para a activação e a quebra de compostos ligados em espécies gasosas.
) Permanece constante. Esta energia interna inclui também a energia necessária para a activação e a quebra de compostos ligados em espécies gasosas.
Este processo é calculado dentro de cálculos de entalpia como  , A rotular a quantidade de energia ou trabalho necessário para "reservar espaço para" e "criar" o sistema; descrevendo o trabalho realizado tanto pela reação ou formação de sistemas, e os arredores. Para sistemas com pressão constante, a variação da entalpia é o calor recebido pelo sistema mais o trabalho não-mecânico que tenha sido feito.
, A rotular a quantidade de energia ou trabalho necessário para "reservar espaço para" e "criar" o sistema; descrevendo o trabalho realizado tanto pela reação ou formação de sistemas, e os arredores. Para sistemas com pressão constante, a variação da entalpia é o calor recebido pelo sistema mais o trabalho não-mecânico que tenha sido feito.
Portanto, a variação da entalpia pode ser concebido ou representados, sem a necessidade de compressão mecânica ou expansivos; para um sistema simples, com um número constante de partículas, a diferença de entalpia é a quantidade máxima de energia térmica derivável de um processo termodinâmico, em que a pressão é mantida constante.
O termo 
 é o trabalho necessário para deslocar a atmosfera circundante, de modo a desocupar o espaço para ser ocupado pelo sistema.
é o trabalho necessário para deslocar a atmosfera circundante, de modo a desocupar o espaço para ser ocupado pelo sistema.
Relacionamentos
Como uma expansão da primeira lei da termodinâmica , entalpia pode estar relacionado a várias outras fórmulas termodinâmicas. Tal como acontece com a definição original da primeira lei;
- Sempre que, tal como definido pela lei;
 representa o aumento da infinitesimal energia sistemática ou interno.
representa o aumento da infinitesimal energia sistemática ou interno.  representa a quantidade ínfima de energia atribuída ou adicionado ao sistema.
representa a quantidade ínfima de energia atribuída ou adicionado ao sistema.  representa a quantidade infinitesimal de energia atuou pelo sistema nos arredores.
representa a quantidade infinitesimal de energia atuou pelo sistema nos arredores.
Como uma expressão de diferenciação, o valor de H pode ser definida como
Onde
|
|
|
|
|
|
|
|
Por um processo que não é reversível, a segunda lei da termodinâmica afirma que o aumento no calor  é inferior ou igual ao produto
é inferior ou igual ao produto  de temperatura
de temperatura  e o aumento da entropia
e o aumento da entropia  ; assim
; assim
Vê-se que, se um processo termodinâmico é isobárica (isto é, ocorre a uma pressão constante), em seguida 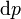 é zero e, assim,
é zero e, assim,
A diferença de entalpia é o máximo atingível energia térmica do sistema de um processo isobárica. Isso explica por que é chamado às vezes o conteúdo de calor. Ou seja, o integral de 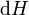 sobre qualquer isobar no espaço de estado é o máximo atingível de energia térmica a partir do sistema.
sobre qualquer isobar no espaço de estado é o máximo atingível de energia térmica a partir do sistema.
Se, além disso, a entropia é mantida constante, bem como, por exemplo,  , A equação acima torna-se:
, A equação acima torna-se:
com a igualdade segurando em equilíbrio. Vê-se que a entalpia de um sistema geral irá diminuir continuamente para o seu valor mínimo, que se mantém no estado de equilíbrio.
De uma forma mais geral, a primeira lei descreve a energia interna com termos adicionais que envolvem a potencial químico e o número de partículas de vários tipos. A declaração diferencial para 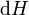 é em seguida:
é em seguida:
onde  é o potencial químico para uma partícula de tipo I, e
é o potencial químico para uma partícula de tipo I, e  é o número de tais partículas. Vê-se que, não só o
é o número de tais partículas. Vê-se que, não só o  termo ser definido como zero, exigindo as pressões dos estados inicial e final a ser o mesmo, mas o
termo ser definido como zero, exigindo as pressões dos estados inicial e final a ser o mesmo, mas o 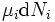 termos deve ser zero, bem como, ao exigir que os números de partículas permanecem inalteradas. Qualquer outra generalização irá adicionar ainda mais termos cujo prazo diferencial extensivo deve ser ajustado para zero para que a interpretação da entalpia para segurar.
termos deve ser zero, bem como, ao exigir que os números de partículas permanecem inalteradas. Qualquer outra generalização irá adicionar ainda mais termos cujo prazo diferencial extensivo deve ser ajustado para zero para que a interpretação da entalpia para segurar.
Calores de reação
A entalpia total de um sistema não pode ser medido diretamente; a variação de entalpia de um sistema é medido em vez disso. Variação de entalpia é definido pela seguinte equação:
onde
- Δ H é a variação de entalpia
- H final é a entalpia final do sistema, medida em joules. Em uma reacção química, H final é a entalpia dos produtos.
- H inicial é a entalpia inicial do sistema, medida em joules. Em uma reacção química, H inicial é a entalpia dos reagentes.
Para um exotérmica da reacção em constante pressão, alteração do sistema de entalpia é igual à energia libertada na reacção, incluindo a energia retida no sistema e perdido através da expansão contra os seus arredores. De um modo semelhante, para uma reacção endotérmica, alterações do sistema da entalpia é igual à energia absorvida na reacção, incluindo a energia perdida pelo sistema de compressão de ganho e de seus arredores. Uma maneira relativamente fácil para determinar se ou não uma reacção é exotérmica ou endotérmica é determinar o sinal de Δ H. Se Δ H é positiva, a reacção é endotérmica, é que o calor é absorvido pelo sistema, devido aos produtos da reacção que tem uma entalpia maior do que os reagentes. Por outro lado, se Δ H é negativo, a reacção é exotérmica, que é a diminuição global da entalpia é conseguido através da geração de calor.
Apesar de entalpia é comumente usado em engenharia e ciência, é impossível medir diretamente, como entalpia não tem datum (ponto de referência). Portanto entalpia só com precisão, pode ser utilizado numa sistema fechado. No entanto, algumas aplicações reais existem isoladamente fechado, e é por esta razão que dois ou mais sistemas fechados não podem ser comparadas utilizando entalpia de base, embora, por vezes, isto é feito erroneamente.
Os sistemas abertos
Em termodinâmica sistemas abertos, a matéria pode fluir para dentro e para fora dos limites do sistema. A primeira lei da termodinâmica para sistemas abertos afirma: o aumento da energia interna de um sistema é igual à quantidade de energia adicionada ao sistema pela matéria que flui dentro e por aquecimento, menos a quantidade perdida pela matéria que flui para fora e em forma . do trabalho realizado pelo sistema A primeira lei para sistemas abertos é dada por:
onde U in é a energia interna média de entrar no sistema e U para fora é a energia interna média deixando o sistema

A região do espaço fechado por fronteiras de sistema aberto é geralmente chamado de controle de volume, e ele pode ou não corresponder às paredes físicas. Se se escolher a forma do volume de controlo de tal forma que todo o fluxo de dentro ou para fora ocorre perpendicularmente à sua superfície, em seguida, o fluxo de matéria para o sistema executa o trabalho como se fosse um êmbolo de massa empurrando fluido para dentro do sistema, e o sistema executa trabalho sobre o fluxo de matéria para fora como se fosse um pistão de condução do fluido. Há, então, dois tipos de trabalhos realizados: fluxo de trabalho descrito acima, que é realizada no fluido (isto também é muitas vezes chamado 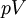 trabalho) e do eixo de trabalho que pode ser executada em qualquer outro dispositivo mecânico.
trabalho) e do eixo de trabalho que pode ser executada em qualquer outro dispositivo mecânico.
Estes dois tipos de trabalho são expressas na equação:
Substituição na equação acima para os rendimentos cv Controle de volume:
A definição de entalpia, H, permite-nos usar este potencial termodinâmico para explicar tanto a energia interna e 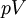 trabalhar em fluidos para sistemas abertos:
trabalhar em fluidos para sistemas abertos:
Durante operação de estado estável de um dispositivo (ver turbina, bomba , e motor), a expressão anterior pode ser definida igual a zero. Isto produz uma expressão útil para a geração de energia ou exigência para estes dispositivos, na ausência de reacções químicas:
Esta expressão é descrita no diagrama acima.
Mudanças de entalpia padrão
Definições
Variação de entalpia padrão de combustão
| " | A entalpia padrão de combustão é definido como a variação de entalpia observada em um sistema termodinâmico constituinte quando 1 mol de uma substância completamente combusts devido ao oxigênio sob condições padrão. | " |
Variação de entalpia padrão de hidrogenação
| " | A entalpia padrão de hidrogenação, é a variação de entalpia observada em um sistema termodinâmico constituinte, quando um mole de um composto insaturado reage completamente com um excesso de hidrogénio, sob condições padrão para formar um composto saturado. | " |
Variação de entalpia padrão de formação
| " | Variação de entalpia padrão de formação é definido como a variação de entalpia observada em um sistema termodinâmico constituinte quando uma mole de um composto é formado a partir dos seus antecedentes elementares sob condições padrão. | " |
Variação de entalpia padrão de reação
| " | Variação de entalpia de reacção padrão (denotado H ° H ou | " |
Entalpia Malha
| " | Entalpia da estrutura é a entalpia necessária para separar uma mole de um composto iónico em iões gasosos separados a uma distância infinita para além (ou seja, nenhuma força de atracção) sob condições padrão. . | " |
A variação de entalpia padrão comum é a variação de entalpia de formação de padrão, que foi determinada para um vasto número de substâncias. A variação de entalpia de qualquer reacção sob quaisquer condições pode ser calculada, tendo em conta a variação de entalpia padrão de formação de todos os reagentes e produtos.
Outros tipos de variação de entalpia padrão incluem combustão ( mudança padrão entalpia de combustão), neutralização ( mudança padrão entalpia de neutralização), fusão / congelação ( variação de entalpia padrão de fusão), vaporização / condensação ( mudança padrão entalpia de vaporização), atomização ( mudança padrão entalpia de atomização), misturando ( mudança padrão entalpia de mistura), dissolução ( variação de entalpia padrão de solução), e desnaturação (variação de entalpia padrão de desnaturação).
Exemplos: Os compostos inorgânicos (a 25 ° C)
| Composto químico | Fase (matéria) | Fórmula química | Δ f H 0 em kJ / mol |
|---|---|---|---|
| Amônia (Hidróxido de Amônio) | aq | NH 3 (NH 4 OH) | -80,8 |
| Amônia | g | NH3 | -46,1 |
| O cobre (II) sulfato | aq | CuSO4 | -769,98 |
| Carbonato de sódio | s | Na 2 CO 3 | -1131 |
| O cloreto de sódio (sal de cozinha) | aq | NaCl | -407 |
| Cloreto de sódio (sal de cozinha) | s | NaCl | -411,12 |
| Cloreto de sódio (sal de cozinha) | l | NaCl | -385,92 |
| Cloreto de sódio (sal de cozinha) | g | NaCl | -181,42 |
| Hidróxido de sódio | aq | NaOH | -469,6 |
| Hidróxido de sódio | s | NaOH | -426,7 |
| Nitrato de sódio | aq | NaNO3 | -446,2 |
| Nitrato de sódio | s | NaNO3 | -424,8 |
| Dióxido de enxofre | g | SO 2 | -297 |
| Ácido sulfúrico | l | H 2 SO 4 | -814 |
| Sílica | s | SiO2 | -911 |
| O dióxido de nitrogênio | g | NO2 | +33 |
| Monóxido de azoto | g | NO | +90 |
| Água | l | H2O | -286 |
| Água | g | H2O | -241,8 |
| Gás carbônico | g | CO2 | -393,5 |
| Hidrogênio | g | H 2 | 0 |
| Flúor | g | F 2 | 0 |
| Cloro | g | Cl 2 | 0 |
| Bromo | l | Br 2 | 0 |
| Bromo | g | Br 2 | +31 |
| Iodo | s | I 2 | 0 |
| Iodo | g | I 2 | +62 |
| O sulfato de zinco | aq | ZnSO4 | -980,14 |
- (Estado: g = gasoso; l = líquido; s = sólida; aq = aquoso)
Entalpia específica
A entalpia específica de um massa trabalhadora é uma propriedade do que a massa usada em termodinâmica , definida como 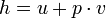 onde u é a energia interna específica, P é a pressão, e V é o volume específico. Em outras palavras,
onde u é a energia interna específica, P é a pressão, e V é o volume específico. Em outras palavras, 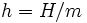 onde
onde  é a massa do sistema. O Unidade do SI para entalpia específica é joules por quilograma.
é a massa do sistema. O Unidade do SI para entalpia específica é joules por quilograma.
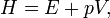
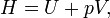
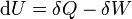

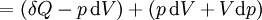

 representa o diferencial inexata.
representa o diferencial inexata. 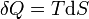 é a energia adicionada pelo aquecimento durante um processo reversível,
é a energia adicionada pelo aquecimento durante um processo reversível,  é o trabalho feito pelo sistema em um processo reversível.
é o trabalho feito pelo sistema em um processo reversível.  é um o volume infinitesimal
é um o volume infinitesimal