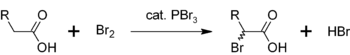Tribrometo de fósforo
Sobre este escolas selecção Wikipedia
Arranjar uma seleção Wikipedia para as escolas no mundo em desenvolvimento sem internet foi uma iniciativa da SOS Children. Patrocínio da criança ajuda as crianças uma a uma http://www.sponsor-a-child.org.uk/ .
| Tribrometo de fósforo | |
|---|---|
 | |
 | |
Tribrometo de fósforo | |
Outros nomes brometo de fósforo (III), | |
| Identificadores | |
| Número CAS | 7789-60-8 |
| PubChem | 24614 |
| ChemSpider | 23016 |
| Número da CE | 232-178-2 |
| Número RTECS | TH4460000 |
| Imagens-jmol 3D | Imagem 1 |
SMILES
| |
InChI
| |
| Propriedades | |
| Fórmula molecular | PBr3 |
| Massa molar | 270,69 g / mol |
| Aparência | líquido límpido e incolor |
| Densidade | 2,852 g / cm 3 |
| Ponto de fusão | -41,5 ° C (231,7 K) |
| Ponto de ebulição | 173,2 ° C (446,4 K) |
| Solubilidade em água | rápido hidrólise |
| Índice de refracção (n D) | 1.697 |
| Viscosidade | 0.001302 Pas |
| Estrutura | |
| Forma molecular | piramidal trigonal |
| Perigos | |
| MSDS | MSDS External |
| Índice da UE | 015-103-00-6 |
| Classificação da UE | Corrosivo (C) |
| Frases R | R14, R34, R37 |
| Frases-S | (S1 / 2), S26, S45 |
| NFPA 704 |  0 3 2 |
| Os compostos relacionados | |
| Outros aniões | trifluoreto de fósforo tricloreto de fósforo triiodeto de fósforo |
| Outros cátions | tribrometo de azoto tribrometo de arsénio antimônio tribrometo |
| Os compostos relacionados | pentabrometo de fósforo oxibrometo de fósforo |
| Página Suplementar dados | |
| Estrutura e Propriedades | N, ε r, etc. |
| Termodinâmica dados | Comportamento de fase Sólido, líquido, gasoso |
| Os dados espectrais | UV, IV, RMN , MS |
Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
Tribrometo de fósforo é um líquido incolor com a fórmula P Br 3. Ele emanações no ar devido à hidrólise e tem um odor penetrante. É amplamente utilizado no laboratório para a conversão de álcoois de brometos de alquilo.
Preparação
PBr3 é preparado por tratamento de fósforo com bromo . Um excesso de fósforo é utilizado, a fim de evitar a formação de PBr 5:
Reações
Tribrometo de fósforo, como PCl 3 e PF 3, tem as duas propriedades de um E uma base de Lewis Ácido de Lewis. Por exemplo, com um ácido de Lewis, tal como tribrometo de boro que constitui 1: 1 estáveis, tais como aductos Br 3 B-PBr3. Ao mesmo tempo PBr3 pode reagir como um electrófilo ou ácido de Lewis, em muitas das suas reacções, por exemplo, com aminas .
A reacção mais importante de PBr3 é com álcoois , onde um substitui OH grupo com um átomo de bromo para produzir um brometo de alquilo. Note-se que todos os três átomos de bromo pode ser transferida.
- PBr3 + 3 ROH 3 → RBr + HP (O) (OH) 2
O mecanismo (mostrado por um álcool primário) envolve a activação inicial do oxigénio do álcool pelo fósforo electrofílico (para formar um bom grupo separável), seguido por uma S N 2 substituição no carbono do álcool.
Por causa do passo 2 S N substituição, a reacção geralmente funciona bem para álcoois primários e secundários , mas não para os álcoois terciários. Se o centro de carbono é a reagir quiral, a reacção ocorre geralmente com inversão de configuração no álcool alfa de carbono, como é habitual com uma reacção S N 2.
Numa reacção semelhante, PBr3 também converte ácidos carboxílicos a brometos de acilo.
- PBr3 + 3 RCOOH 3 → RCOBr + HP (O) (OH) 2
PBr3 é razoavelmente forte agente redutor, ea oxidação de PBr3 com oxigênio gás é mais vigorosa do que a observada com PCI3. Ele dá uma reação explosiva que se forma P 2 O 5 e Br 2 .
Aplicações
A principal utilização de tribrometo de fósforo é utilizado para conversão de primários ou secundários álcoois de brometos de alquilo, como descrito acima. PBr3 normalmente dá rendimentos superiores aos ácido bromídrico, e que evita os problemas de carbocatião rearrangement- por exemplo, mesmo brometo de neopentilo pode ser feita a partir do álcool em 60% de rendimento.
Outra utilização para PBr3 é como um catalisador para a α-bromação de ácidos carboxílicos . Embora brometos de acilo são raramente feito em comparação com cloretos de acilo, que são usados como intermediários na Hell-Volhard-Zelinsky halogenação. Inicialmente PBr3 reage com o ácido carboxílico para formar o brometo de acilo, que é mais reactiva para a bromação. O processo global pode ser representado como
Numa escala comercial, tribrometo de fósforo é utilizado no fabrico de produtos farmacêuticos, tais como alprazolam, metoexital e fenoprofen. É também um potente agente de supressão de fogo comercializado sob o nome PhostrEx.
Precauções
PBr3 evolui HBr corrosivo, é tóxico, e reage violentamente com água e álcoois.
Em reacções que produzem ácido fosforoso como um sub-produto, ao trabalhar-se por destilação estar ciente de que esta pode decompor-se acima de cerca de 160 ° C para dar fosfina, que pode provocar explosões em contacto com o ar.