
De cobre (I) cloruro de
Sabías ...
SOS ofrecen una descarga completa de esta selección de escuelas para su uso en escuelas intranets. El apadrinamiento de niños ayuda a los niños uno por uno http://www.sponsor-a-child.org.uk/ .
| De cobre (I) cloruro de | |
|---|---|
 | |
 | |
De cobre (I) cloruro de | |
Otros nombres Cloruro cuproso | |
| Identificadores | |
| CAS | 7758-89-6 |
| Número RTECS | GL6990000 |
| Propiedades | |
| Fórmula molecular | CuCl |
| Masa molar | 98.99 g / mol |
| Apariencia | polvo blanco, ligeramente verde de impurezas oxidadas |
| Densidad | 4,140 g / cm 3, sólida |
| Punto de fusion | 430 ° C (703 K) |
| Punto de ebullicion | 1490 ° C (1760 K), |
| Solubilidad en agua | 0,0062 g / 100 ml (20 ° C) |
| Estructura | |
| Estructura cristalina | Tetraédrica empaquetada ( Zinc estructura blenda) |
| Peligros | |
| MSDS | ScienceLab.com |
| R declaración / S | R: 22, 50, 53 S: 22, 60/61 |
| Principal peligros | Irritante |
| NFPA 704 |  0 3
0 |
| Compuestos relacionados | |
| Otros aniones | De cobre (I) bromuro de De cobre (I) yoduro de |
| Otros cationes | Cobre (II) cloruro de Silver (I) cloruro de |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
Cobre (I) cloruro, comúnmente llamado cloruro de cobre, es la más baja cloruro de cobre , con la fórmula de CuCl. Este sólido incoloro es un precursor versátil para otros compuestos de cobre, incluidos algunos de importancia comercial. Ocurre naturalmente como el raro mineral nantokite. A diferencia de otros haluros de metales de transición de la primera fila, se forma una estable complejos con monóxido de carbono . Se cristaliza en una diamondoid motivo, lo que refleja la tendencia de cobre (I) para formar complejos tetraédricos.
Preparación
De cobre (I) cloruro de se produce industrialmente mediante la cloración directa de cobre:
- 2 Cu + Cl 2 → 2 CuCl
En el laboratorio, de cobre (I) de cloruro se puede preparar por la reducción de cobre (II) sales tales como CuSO 4 utilizando dioxido de azufre, bisulfito de sodio (NaHSO3), metabisulfito de sodio, o de cobre metal.
- 2 CuCl 2 + H 2 O + SO 3 2- → 2 CuCl + SO 4 2 + 2 Cl -
Los precipitados sólido blanco a partir de la solución. Al pie en el aire húmedo, las muestras de CuCl se vuelven verdes debido a la formación de cobre (II) cloruros.
Propiedades químicas
CuCl es más asequible y menos tóxico que otros ácidos de Lewis suaves. Además, el cobre puede existir en múltiples estados redox, incluyendo I, II, y III. Esta combinación de propiedades definen algunas de las características útiles de cobre (I) de cloruro. Es un suave Ácido de Lewis, clasificado como suave de acuerdo con la Concepto Hard-Soft ácido-base. Por lo tanto, tiende a formar estable complejos con suave Bases de Lewis tales como trifenilfosfina:
- CuCl + P (C 6 H 5) 3 → [CuCl (P (C 6 H 5) 3)] 4
Aunque CuCl es insoluble en agua, se disuelve en soluciones acuosas que contienen moléculas de donantes adecuados. Se forma complejos con iones haluro, por ejemplo formando H 3 O + CuCl2 - con concentrado de ácido clorhídrico . También disuelve en soluciones que contienen CN -, S 2 O 3 2-, y NH 3 para dar complejos.
Soluciones de CuCl en HCl o NH 3 absorben monóxido de carbono para formar complejos incoloros tales como el dímero de cloruro de puente [CuCl (CO)] 2. Las mismas soluciones de ácido clorhídrico también reaccionan con acetileno gas para formar [CuCl (C 2 H 2)]. amoniacales soluciones de CuCl reaccionan con acetilenos para formar el explosivo de cobre (I) acetiluro. Complejos de CuCl con alquenos se pueden preparar por reducción de CuCl 2 por dióxido de azufre en la presencia del alqueno en solución de alcohol. Complejos con dienos tales como 1,5-ciclooctadieno son particularmente estables:

Aunque sólo poco soluble en agua, su solución acuosa son inestables con respecto a desproporción en Cu y CuCl 2 . En parte por esta razón muestras asumen una coloración verde (véase la fotografía en la parte superior derecha).
Usos
El uso principal de cobre (i) cloruro es como un precursor de la oxicloruro de cobre fungicida. Para este propósito acuosa de cobre (I) de cloruro es generado por Conmutación y luego oxidado con aire:
- Cu + CuCl 2 → 2 CuCl
- 6 CuCl + 3/2 O2 + 3 H 2 O → 2 Cu 3 Cl 2 (OH) 4 + CuCl2
De cobre (I) cloruro de cataliza una variedad de reacciones orgánicas, como se discutió anteriormente. Su afinidad por el monóxido de carbono en presencia de cloruro de aluminio es explotada en el proceso COPure SM.
En síntesis orgánica
En el Reacción de Sandmeyer. El tratamiento de una arenediazonium sal con CuCl conduce a un cloruro de arilo, por ejemplo:
 La reacción tiene amplio alcance y por lo general da buenos rendimientos.
La reacción tiene amplio alcance y por lo general da buenos rendimientos.
Los primeros investigadores observaron que cobre (I) haluros catalizan la adición 1,4 de Reactivos de Grignard a alfa, beta-insaturados cetonas condujeron al desarrollo de reactivos organocuprato que son ampliamente utilizados hoy en síntesis orgánica:
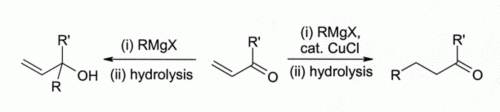 Este hallazgo condujo al desarrollo de química organocobre. Por ejemplo, reacciona con CuCl metil (CH3 Li) para formar " Gilman "reactivos, tales como (CH 3) 2 Culi, que encuentran amplio uso en la síntesis orgánica. Reactivos de Grignard reaccionan de manera similar. Aunque otros cobre (I) compuestos tales como de cobre (I) yoduro de ahora se utilizan más a menudo para estos tipos de reacciones, de cobre (I) cloruro de todavía se recomienda en algunos casos:
Este hallazgo condujo al desarrollo de química organocobre. Por ejemplo, reacciona con CuCl metil (CH3 Li) para formar " Gilman "reactivos, tales como (CH 3) 2 Culi, que encuentran amplio uso en la síntesis orgánica. Reactivos de Grignard reaccionan de manera similar. Aunque otros cobre (I) compuestos tales como de cobre (I) yoduro de ahora se utilizan más a menudo para estos tipos de reacciones, de cobre (I) cloruro de todavía se recomienda en algunos casos:
 Aquí, Bu indica un n- grupo butilo. Sin CuCl, la Reactivo de Grignard único que da una mezcla de 1,2- y 1,4-adición de productos (es decir, la suma de butilo en la más cerca del C = O).
Aquí, Bu indica un n- grupo butilo. Sin CuCl, la Reactivo de Grignard único que da una mezcla de 1,2- y 1,4-adición de productos (es decir, la suma de butilo en la más cerca del C = O).
En la química de polímeros
De cobre (I) cloruro de también es un intermedio formado a partir de cobre (II) cloruro en el Proceso Wacker. CuCl se utiliza como un catalizador en Atom Transfer Radical polimerización (ATRP).
