
VIH
Antecedentes de las escuelas de Wikipedia
SOS Children, una organización benéfica educación , organizó esta selección. Ver http://www.soschildren.org/sponsor-a-child para averiguar sobre el apadrinamiento de niños.
| Virus de inmunodeficiencia humana | |
|---|---|
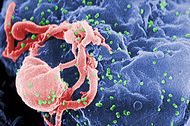 | |
| Micrografía electrónica de barrido del VIH-1 (en verde) en ciernes de linfocito cultivado. Protuberancias redondeadas y múltiples en la superficie celular representan los sitios de reunión y en ciernes de los viriones. | |
| Clasificación Virus | |
| Grupo: | Grupo VI ( ssRNA-RT) |
| Familia: | Retroviridae |
| Género: | Lentivirus |
| Especies | |
| |
Virus de la inmunodeficiencia humana (VIH) es una lentivirus (replicando lentamente retrovirus) que causa el síndrome de inmunodeficiencia adquirida (SIDA), una enfermedad en los seres humanos en los que el fracaso progresivo del sistema inmunológico permite que amenaza la vida infecciones oportunistas y cánceres prosperen. La infección con el VIH se produce por la transferencia de la sangre , semen, fluido vaginal, antes de la eyaculación, o la leche materna. Dentro de estos fluidos corporales, el VIH está presente como partículas libres de virus y virus dentro de infectados células inmunes.
El VIH infecta las células vitales en el sistema inmunitario humano, tales como Las células T colaboradoras (en concreto Células T CD4 +), macrófagos, y células dendríticas. La infección conduce a bajos niveles de Células T CD4 + a través de un número de mecanismos que incluyen: la apoptosis de las células espectadoras no infectadas, matanza viral directa de las células infectadas, y la muerte de las células T CD4 + infectados por CD8 citotóxicos que reconocen las células infectadas. Cuando el número de células T CD4 + disminuyen por debajo de un nivel crítico, se pierde la inmunidad mediada por células, y el cuerpo se vuelve progresivamente más susceptibles a las infecciones oportunistas.
Virología
Clasificación
| Especies | Virulencia | La infectividad | Predominio | Origen inferido |
|---|---|---|---|---|
| VIH-1 | Alto | Alto | Global | Chimpancé común |
| VIH-2 | Inferior | Bajo | África Occidental | Hollín Mangabey |
El VIH es un miembro de la género Lentivirus, parte de la familia de Retroviridae. Los lentivirus tienen muchos morfologías y biológicos propiedades en común. Muchas especies están infectadas por lentivirus, que son característicamente responsables de enfermedades de larga duración con un largo periodo de incubación. Los lentivirus se transmiten como de cadena sencilla, positiva sentido, envuelto Virus de ARN. A la entrada en la célula diana, el viral ARN genoma se convierte (transcripción reversa) en de doble cadena de ADN por un codificada viralmente la transcriptasa inversa que se transporta junto con el genoma viral en la partícula de virus. El ADN viral resultante se importa en el núcleo de la célula y se integra en el ADN celular por un viralmente codificada integrasa y de acogida cofactores. Una vez integrado, el virus puede convertirse latente, permitiendo que el virus y su célula huésped para evitar la detección por el sistema inmune. Alternativamente, el virus puede estar transcrita, la producción de nuevos genomas de ARN y las proteínas virales que están empaquetados y liberados de la célula como nuevas partículas del virus que empiezan el ciclo de replicación de nuevo.
Dos tipos de VIH se han caracterizado: el VIH-1 y VIH-2. VIH-1 es el virus que fue descubierto inicialmente y denomina tanto LAV y HTLV-III. Es más virulenta, más infecciosa, y es la causa de la mayoría de las infecciones por VIH en el mundo. La infectividad inferior de VIH-2 en comparación con el VIH-1 implica que menos de las personas expuestas al VIH-2 se infectarán por la exposición. Debido a su relativamente baja capacidad de transmisión, el VIH-2 se limita principalmente a África Occidental .
Estructura y genoma

VIH es diferente en estructura de otros retrovirus. Es más o menos esférica con un diámetro de aproximadamente 120 nm, alrededor de 60 veces más pequeño que un de células rojas de la sangre, sin embargo, grande para un virus. Se compone de dos copias de positivo monocatenario ARN que codifica para el virus de nueve genes cerrados por un cónica cápside compone de 2.000 copias de la proteína viral p24. El ARN monocatenario está estrechamente ligada a la nucleocápside proteínas, p7, y las enzimas necesarias para el desarrollo del virión como la transcriptasa inversa, proteasas, ribonucleasa y integrasa. Una matriz compuesta de la proteína p17 viral rodea la cápside asegurar la integridad de la partícula del virión.
Esto es, a su vez, rodeado por el envoltura viral que se compone de dos capas de moléculas grasas llamadas fosfolípidos tomadas de la membrana de una célula humana cuando un recién formadas brotes de partículas de virus a partir de la célula. Incrustado en la envoltura viral son las proteínas de la célula huésped y aproximadamente 70 copias de un complejo de proteínas del VIH que sobresale a través de la superficie de la partícula de virus. Esta proteína, conocida como Env, consiste en un capuchón de tres moléculas llamadas glicoproteína (gp) 120, y un vástago que consta de tres moléculas de gp41 que anclan la estructura en la envoltura viral. Este complejo de glicoproteína permite al virus adherirse a y fusionarse con células diana para iniciar el ciclo infeccioso. Tanto estas proteínas de superficie, especialmente gp120, se han considerado como objetivos de tratamientos o futuras vacunas contra el VIH.
El genoma de ARN consiste en al menos siete puntos de referencia estructurales ( LTR, TAR, RRE, PE, SLIP, CRS, y el INS), y nueve genes (gag, pol, y env, tat, rev, nef, vif, vpr, vpu, ya veces una décima TeV, que es una fusión de env tat y rev ), que codifica 19 proteínas. Tres de estos genes, gag, pol y env, contienen información necesaria para hacer las proteínas estructurales de nuevas partículas virales. Por ejemplo, los códigos de env para una proteína llamada gp160 que se descompone por una proteasa celular para formar gp120 y gp41. El seis genes restantes, tat, rev, nef, vif, vpr, vpu y (o vpx en el caso de VIH-2), son genes reguladores para las proteínas que controlan la capacidad del VIH para infectar las células, producir nuevas copias de virus ( replicar), o provocar una enfermedad.
Las dos proteínas Tat (p16 y p14) son transactivadores transcripción para el promotor LTR actuar mediante la unión del elemento TAR ARN. El TAR también se puede procesar en microRNAs que regulan la genes de apoptosis ERCC1 y IER3. La Rev proteína (p19) está involucrado en shuttling RNAs desde el núcleo y el citoplasma mediante la unión a la RRE elemento de ARN. La proteína Vif (p23) impide la acción de APOBEC3G (una proteína celular que desamina híbridos ADN: ARN y / o interfiere con la proteína Pol). La Proteína VPR (p14) arrestos la división celular en G2 / M. La proteína Nef (p27) regula a la baja CD4 (el receptor viral mayor), así como la MHC de clase I y moléculas de clase II.
Nef también interactúa con Dominios SH3. La proteína Vpu (p16) influye en la liberación de nuevas partículas del virus de las células infectadas. Los extremos de cada hebra de ARN de VIH contienen una secuencia de ARN llamado repetición terminal larga (LTR). Regiones en la LTR actúan como conmutadores para controlar la producción de nuevos virus y puede ser activado por proteínas de VIH o la célula huésped. La Elemento Psi está involucrado en el empaquetado del genoma viral y reconocido por las proteínas Gag y Rev. El elemento SLIP (TTTTTT) está implicada en la de desplazamiento de marco en el marco de lectura Gag-Pol requerida para hacer Pol funcional.
Tropismo

El término tropismo viral se refiere a que infecta tipos de células VIH. VIH puede infectar una variedad de células inmunes tales como Células T CD4 +, macrófagos, y células microgliales. VIH-1 de entrada a los macrófagos y las células T CD4 + está mediada por la interacción de las glicoproteínas de la envoltura del virión (gp120) con la molécula CD4 en las células diana y también con correceptores de quimiocinas.
Macrófagos (M-trópico) cepas de VIH-1, o no cepas syncitia inductores (INE) usan el receptor de quimioquinas β CCR5 para la entrada y son, por lo tanto, capaz de replicarse en los macrófagos y las células T CD4 +. Esta co-receptor CCR5 es utilizado por casi todos primaria por VIH-1 aislados independientemente del subtipo genético viral. De hecho, los macrófagos juegan un papel clave en varios aspectos críticos de la infección por VIH. Parecen ser las primeras células infectadas por el VIH y quizás la fuente de la producción de VIH cuando las células CD4 + se agotan en el paciente. Los macrófagos y células de la microglía son las células infectadas por el VIH en el sistema nervioso central. En amígdalas y adenoides de pacientes infectados por el VIH, los macrófagos se fusionan en las células gigantes multinucleadas que producen grandes cantidades de virus.
Aislados T-trópicos, o sincitios que inducen (SI) cepas de replicarse en células primarias T CD4 + así como en macrófagos y el uso del receptor de quimioquinas α, CXCR4, para la entrada. Dual-trópico VIH-1 cepas se cree que son las cepas de transición de VIH-1 y por lo tanto son capaces de utilizar tanto CCR5 y CXCR4 como co-receptores para la entrada del virus.
El quimioquinas α SDF-1, un ligando para CXCR4, suprime la replicación del T-trópico VIH-1 aislados. Esto se hace por abajo de la regulación de la expresión de CXCR4 en la superficie de estas células. VIH que utilizan sólo el receptor CCR5 se denominan R5; los que utilizan sólo CXCR4 se denominan X4, y los que utilizan ambos, X4R5. Sin embargo, el uso de co-receptor sola no explica el tropismo viral, ya que no todos los virus R5 son capaces de utilizar CCR5 en los macrófagos para una infección productiva y el VIH también puede infectar a un subtipo de células dendríticas mieloides, que probablemente constituyen un reservorio que mantiene la infección cuando el número de células T CD4 + se han reducido a niveles extremadamente bajos.
Algunas personas son resistentes a ciertas cepas de VIH. Por ejemplo, las personas con el Mutación CCR5-Δ32 son resistentes a la infección con el virus R5, como la mutación se detiene el VIH de la unión a este correceptor, reduciendo su capacidad de infectar células diana.
Las relaciones sexuales son el principal modo de transmisión del VIH. Tanto X4 y VIH R5 están presentes en el líquido seminal, que se transmite de un hombre a su pareja sexual. Los viriones pueden luego infectar a numerosos objetivos celulares y difundir en todo el organismo. Sin embargo, un proceso de selección permite una transmisión predominante del virus R5 través de esta vía. ¿Cómo funciona este proceso selectivo es todavía bajo investigación, pero un modelo es que espermatozoides puede llevar selectivamente R5 del VIH, ya que poseen tanto CCR3 y CCR5, pero no CXCR4 en su superficie y que genital células epiteliales preferentemente secuestran virus X4. En los pacientes infectados con el subtipo B del VIH-1, a menudo hay un interruptor de co-receptor en la enfermedad de la última etapa y variantes T-trópico parece que puede infectar a una variedad de células T a través de CXCR4. Estas variantes se replican de manera más agresiva con la virulencia aumentada que causa un rápido agotamiento de las células T, el colapso del sistema inmune, y las infecciones oportunistas que marcan la aparición del SIDA. Así, durante el curso de la infección, la adaptación viral para el uso de CXCR4 en lugar de CCR5 puede ser un paso clave en la progresión a SIDA. Una serie de estudios con individuos subtipo B infectadas han determinado que entre el 40 y el 50 por ciento de los pacientes con SIDA puede albergar virus de la SI y, se supone, los fenotipos X4.
VIH-2 es mucho menos patógenas que el VIH-1 y está restringida en su distribución en todo el mundo. La adopción de "genes accesorios" por el VIH-2 y su patrón más promiscuo de uso del correceptor (incluyendo CD4-independencia) puede ayudar al virus en su adaptación para evitar los factores de restricción innatas presentes en las células huésped. Adaptación a utilizar maquinaria celular normal para permitir la transmisión e infección productiva también ha ayudado a la creación de la replicación del VIH-2 en los seres humanos. Una estrategia de supervivencia para cualquier agente infeccioso no es matar a su huésped, pero en última instancia, convertirse en un organismo comensal. Después de haber logrado una patogenicidad baja, con el tiempo, las variantes más éxito en la transmisión será seleccionado.
Ciclo de replicación

La entrada a la célula
Entra VIH macrófagos y CD4 + Las células T por parte de la adsorción de glicoproteínas en su superficie a los receptores en la célula diana seguido por la fusión de la envoltura viral con la membrana celular y la liberación de la cápside del VIH en la célula.
La entrada a la célula comienza través de la interacción de la envolvente compleja trimérica ( pico gp160) y ambos CD4 y un receptor de quimioquinas (por lo general, ya sea CCR5 o CXCR4, pero otros se sabe que interactúan) en la superficie celular. gp120 se une a integrina α 4 β 7 de activación LFA-1 de la integrina centrales implicados en el establecimiento de las sinapsis virológicas, que facilitan la célula a la propagación de células de VIH-1 eficiente. El pico gp160 contiene dominios de unión de CD4 y los receptores de quimioquinas.
El primer paso en la fusión implica la unión de alta afinidad de la CD4 dominios de unión gp120 a CD4. Una vez que gp120 se une con la proteína CD4, la envolvente compleja se somete a un cambio estructural, exponiendo los dominios de unión de gp120 de quimioquinas y que les permite interactuar con el receptor de quimioquinas diana. Esto permite una unión de dos puntas más estable, lo que permite que el péptido de fusión gp41 N-terminal para penetrar la membrana celular. Secuencias de repetición en gp41, HR1, HR2 y entonces interactúan, provocando el colapso de la porción extracelular de gp41 en una horquilla. Esta estructura de bucle trae las membranas del virus y de la célula muy juntas, lo que permite la fusión de las membranas y la posterior entrada de la cápside viral.
Después de VIH se ha unido a la célula diana, el VIH RNA y varios enzimas, incluyendo la transcriptasa inversa, integrasa, ribonucleasa, y la proteasa, se inyectan en la célula. Durante el transporte de microtúbulos basado en el núcleo, el genoma viral de ARN de una sola hebra se transcribe en ADN de doble hebra, que se integra a continuación en un cromosoma del huésped.
VIH puede infectar Las células dendríticas (DC) de este CD4 Ruta CCR5, pero otra ruta utilizando receptores de lectina tipo C específicas de manosa tales como DC-SIGN también se puede utilizar. DCs son una de las primeras células encontradas por el virus durante la transmisión sexual. Se cree actualmente que juegan un papel importante en la transmisión del VIH a las células T cuando se captura el virus en el mucosa por países en desarrollo. La presencia de FEZ-1, que se produce naturalmente en neuronas, se cree que previene la infección de las células por el VIH.
Replicación y transcripción
Poco después de la cápside viral entra en la célula, una enzima llamada la transcriptasa inversa libera el de una sola hebra (+) Genoma de ARN de las proteínas virales unidos y lo copia en un ADN complementario (ADNc) molécula. El proceso de la transcripción inversa es muy propenso a errores, y las mutaciones resultantes puede causar resistencia a los medicamentos o permitir que el virus para evadir el sistema inmune del cuerpo. La transcriptasa inversa también tiene actividad de ribonucleasa que degrada el ARN viral durante la síntesis de ADNc, así como la actividad ADN polimerasa dependiente de ADN que crea una ADN sentido a partir del ADNc antisentido. Juntos, el cDNA y su complemento forman un ADN de doble hebra viral que se transporta a continuación en el núcleo de la célula. La integración del ADN viral en la célula huésped de genoma se lleva a cabo por otra enzima viral llamada integrasa.

Este ADN viral integrado puede entonces permanecer en estado latente, en la fase latente de la infección por VIH. Para producir activamente el virus, cierta celular factores de transcripción tienen que estar presentes, el más importante de los cuales es NF-κ B (NF kappa B), que se regula positivamente cuando las células T se activan. Esto significa que las células con más probabilidades de ser asesinado por el VIH son los que actualmente lucha contra la infección.
Durante la replicación viral, el ADN integrado provirus es transcrito en ARNm, que luego se empalmado en pedazos más pequeños. Estas pequeñas piezas se exportan desde el núcleo hacia el citoplasma, donde están traducido a las proteínas reguladoras Tat (que estimula nueva producción de virus) y Rev. Como la proteína Rev recién producido se acumula en el núcleo, se une al ARNm virales y permite ARN unspliced para dejar el núcleo, donde son retenidos hasta que de otro modo empalmados. En esta etapa, las proteínas estructurales Gag y Env se producen a partir del ARNm de longitud completa. El ARN de longitud completa es en realidad el genoma del virus; se une a la proteína Gag y se empaqueta en nuevas partículas de virus.
VIH-1 y VIH-2 parecen empaquetar su ARN diferente; VIH-1 se unirá a cualquier ARN apropiada, mientras que el VIH-2 se unen preferentemente al ARNm que se utilizó para crear la proteína Gag sí mismo. Esto puede significar que el VIH-1 es más capaz de mutar (VIH-1 infección progresa al SIDA más rápido que el VIH-2 infección y es responsable de la mayoría de las infecciones mundiales).
Asamblea y la liberación

El paso final del ciclo viral, el montaje de nuevos viriones del VIH-1, comienza en la membrana plasmática de la célula huésped. La poliproteína Env (gp160) pasa a través de la retículo endoplásmico y es transportado a la Complejo de Golgi donde se escinde por furina resultante en las dos glicoproteínas de la envoltura del VIH, gp41 y gp120. Estos son transportados a la membrana plasmática de la célula huésped donde gp41 ancla gp120 de la membrana de la célula infectada. Los gag (p55) y Gag-Pol (p160) poliproteínas también asocian con la superficie interna de la membrana plasmática junto con el ARN genómico del VIH como la formación de virión comienza a brotar de la célula huésped. El virión brotado todavía inmadura como la poliproteínas gag todavía necesitan ser escindido en la matriz real, cápside y proteínas de la nucleocápside. Esta escisión está mediada por la proteasa viral también envasados y puede ser inhibida por medicamentos antirretrovirales de la clase de los inhibidores de la proteasa. Los diversos componentes estructurales a continuación, se ensamblan para producir un virión maduro VIH. Solamente los viriones maduros son capaces de infectar a otra celda.
La variabilidad genética

VIH difiere de muchos virus, ya que tiene muy alto la variabilidad genética. Esta diversidad es una consecuencia de su rápido ciclo de replicación , con la generación de alrededor de 10 10 viriones cada día, junto con un alto tasa de mutación de aproximadamente 3 x 10 -5 por base de nucleótido por ciclo de replicación y propiedades recombinogenic de la transcriptasa inversa.
Este escenario complejo conduce a la generación de muchas variantes del VIH en un solo paciente infectado en el curso de un día. Esta variabilidad se agrava cuando una única célula se infecta simultáneamente por dos o más cepas diferentes de VIH. Cuando se produce la infección simultánea, el genoma de los viriones progenie puede estar compuesta de cadenas de ARN a partir de dos cepas diferentes. Este virión híbrido entonces infecta una nueva célula donde se somete a la replicación. Mientras esto sucede, la transcriptasa inversa, saltando hacia atrás y adelante entre las dos plantillas de ARN diferentes, generará una retroviral recién sintetizado Secuencia de ADN que es un recombinante entre los dos genomas parentales. Esta recombinación es más evidente cuando se produce entre los subtipos.
El estrechamente relacionados virus de la inmunodeficiencia simia (SIV) se ha convertido en muchas cepas, clasificados por las especies huéspedes naturales. Cepas de SIV de la Mono verde africano (SIVagm) y mangabey tiznado (SIVsmm) se cree que tienen una larga historia evolutiva con sus anfitriones. Estos anfitriones se han adaptado a la presencia del virus, que está presente en altos niveles en la sangre del huésped, pero evoca sólo una respuesta inmune leve, no causar el desarrollo de simio SIDA, y no someterse a la extensa mutación y recombinación típico de VIH la infección en seres humanos.
En contraste, cuando estas cepas infectan especies que no se han adaptado a SIV (hosts "heterólogo" tales como rhesus o cynomolgus macacos), los animales desarrollan el SIDA y el virus genera diversidad genética similar a lo que se ve en la infección humana por el VIH. Chimpancé SIV (VIS), el pariente más cercano genética del VIH-1, se asocia con una mayor mortalidad y síntomas similares al SIDA en su huésped natural. SIVcpz parece haber sido transmitido hace relativamente poco a los chimpancés y las poblaciones humanas, por lo que sus anfitriones aún no se han adaptado al virus. Este virus también ha perdido una función de la Gen Nef que está presente en la mayoría de los SIV; sin esta función, la depleción de células T es más probable, que conduce a la inmunodeficiencia.
Tres grupos de VIH-1 han sido identificados sobre la base de las diferencias en el sobre (env) Región: M, N y O. Grupo M es la más frecuente y se subdivide en ocho subtipos (o clados), basado en todo el genoma, que son geográficamente distinto. El más frecuente son los subtipos B (que se encuentran principalmente en América del Norte y Europa), A y D (que se encuentra principalmente en África), y C (que se encuentran principalmente en África y Asia); estos subtipos forman ramas en el árbol filogenético que representan el linaje del grupo M del VIH-1. La coinfección por subtipos distintos da lugar a formas recombinantes circulantes (CRF). En 2000, último año en que se realizó un análisis de la prevalencia del subtipo global, el 47,2% de las infecciones en todo el mundo eran del subtipo C, el 26,7% eran del subtipo A / CRF02_AG, el 12,3% eran del subtipo B, el 5,3% eran del subtipo D, 3,2% eran de CRF_AE, y el 5,3% restante se compone de otros subtipos y CRF. La mayoría del VIH-1 la investigación se centra en el subtipo B; pocos laboratorios se centran en los otros subtipos. La existencia de un cuarto grupo, "P", ha sido la hipótesis basada en un virus aislado en 2009. La cepa es aparentemente deriva de gorila SIV (SIVgor), primer aislado de gorilas de tierras bajas occidentales en 2006.
La secuencia genética del VIH-2 es sólo parcialmente homóloga a VIH-1 y más estrechamente se parece al de SIVsmm.
Diagnóstico

Muchas personas con VIH no saben que están infectadas con el virus. Por ejemplo, en 2001 menos del 1% de la población urbana sexualmente activos en África había sido probado, y esta proporción es aún menor en las poblaciones rurales. Por otra parte, en 2001 sólo el 0,5% de las mujeres embarazadas que acuden a centros de salud urbanos se aconsejó, probado o recibir sus resultados de la prueba. Una vez más, esta proporción es aún menor en los centros de salud rurales. Así que, por los donantes pueden no ser conscientes de su infección, donantes de sangre y productos sanguíneos utilizados en la medicina y la la investigación médica son examinados rutinariamente para el VIH.
VIH-1 prueba es inicialmente por un ensayo de inmunoabsorción ligado a enzimas (ELISA) para detectar anticuerpos contra el VIH-1. Las muestras con un resultado no reactivo de la inicial ELISA se consideran VIH-negativo menos que haya ocurrido nueva exposición a una persona infectada o pareja que desconocen su estado de VIH. Las muestras con un resultado reactivo ELISA son examinados nuevamente por duplicado. Si el resultado de cualquiera de las pruebas por duplicado es reactivo, la muestra corresponde a repetidamente reactivos y se somete a pruebas de confirmación con una prueba complementaria más específica (por ejemplo, Western blot o, con menor frecuencia, un ensayo de inmunofluorescencia (IFA)). Sólo los especímenes que son repetidamente reactivas por ELISA y positiva por IFA o reactivo por Western blot se consideran VIH-positivo y indicativo de infección por VIH. Las muestras que son repetidamente reactivos a ELISA de vez en cuando proporcionan un resultado de Western blot indeterminado, que puede ser una respuesta de anticuerpos incompletos al VIH en una persona infectada o reacciones no específicas en una persona no infectada.
Aunque IFA se puede utilizar para confirmar la infección en estos casos ambiguos, este ensayo no se utiliza ampliamente. En general, un segundo espécimen deben recogerse más de un mes más tarde y ensayarse para personas con Western blot resultados indeterminados. Aunque mucho menos comúnmente disponibles, las pruebas de ácido nucleico (por ejemplo, ARN viral o método de amplificación de ADN proviral) también puede ayudar al diagnóstico en ciertas situaciones. Además, algunos especímenes analizados podrían proporcionar resultados no concluyentes debido a la baja cantidad de muestras. En estas situaciones, una segunda muestra se recolecta y se prueba para la infección por VIH.
La prueba del VIH moderna es extremadamente precisa. Una sola prueba de detección es correcta más de 99% del tiempo. La posibilidad de un resultado falso positivo en el protocolo estándar de prueba de dos pasos se estima en aproximadamente 1 de cada 250.000 en una población de bajo riesgo. Se recomienda realizar pruebas de post-exposición inicialmente y a las seis semanas, tres meses y seis meses.
Investigación
La investigación del VIH / SIDA incluye todo la investigación médica que trata de prevenir, tratar o curar el VIH / SIDA , así como la investigación fundamental sobre la naturaleza del VIH como un agente infeccioso y el SIDA como la enfermedad causada por el VIH.
En la actualidad, no existe cura para el VIH / SIDA. El método más universalmente recomendada para la prevención del VIH / SIDA es evitar el contacto de sangre con sangre entre las personas y de practicar lo contrario sexo seguro. El método más recomendado para el tratamiento de VIH es de por Las personas VIH-positivas que reciben atención por parte de un médico que se encargaría de coordinar con las del paciente gestión del VIH / SIDA. No existe una cura para el VIH / SIDA .
Muchos gobiernos y las instituciones de investigación participan en la investigación del VIH / SIDA. Esta investigación incluye conductual las intervenciones de salud, como la investigación en la educación sexual, y el desarrollo de fármacos, como la investigación en microbicidas para las enfermedades de transmisión sexual, Vacunas contra el VIH, y los medicamentos antirretrovirales. Otras áreas de investigación médica incluyen los temas de la profilaxis pre-exposición, profilaxis post-exposición, y La circuncisión y el VIH.
Historia
Descubrimiento
SIDA primero fue observado clínicamente en 1981 en los Estados Unidos. Los casos iniciales fueron un grupo de usuarios de drogas inyectables y hombres gay sin causa conocida de alteraciones de la inmunidad que mostró síntomas de La neumonía por Pneumocystis carinii (PCP), una infección oportunista raro que se sabe que se producen en personas con sistemas inmunológicos muy comprometidos. Poco después, los hombres gay adicionales desarrollaron un cáncer de piel previamente rara llamada Sarcoma de Kaposi (KS). Muchos más casos de PCP y KS surgieron, alertando a los Centros para el Control y la Prevención de Enfermedades (CDC) y un grupo de trabajo CDC se formó para controlar el brote.
En un principio, el CDC no tenía un nombre oficial para la enfermedad, a menudo refiriéndose a ella a través de las enfermedades que se asocian con él, por ejemplo, linfadenopatía, la enfermedad después de que los descubridores del VIH Originalmente llamado el virus. También utilizaron el sarcoma de Kaposi e Infecciones Oportunistas, el nombre con el que un grupo de trabajo se había establecido en 1981. En la prensa general, el término GRID, que se mantuvo para relacionados con gay-inmunodeficiencia, había sido acuñado. El CDC, en busca de un nombre, y mirando a las comunidades infectadas acuñados "la enfermedad 4H", ya que parecía señalar a los haitianos , homosexuales, hemofílicos y consumidores de heroína. Sin embargo, después de determinar que el SIDA no se aisló a la comunidad gay, se dio cuenta de que el término GRID era engañosa y el SIDA se introdujo en una reunión en julio de 1982. En septiembre de 1982, el CDC comenzó a usar el nombre de SIDA.

En 1983, dos grupos de investigación independientes dirigidos por Robert Gallo y Luc Montagnier declaró independiente de que un nuevo retrovirus puede haber estado infectando los pacientes con SIDA, y publicó sus hallazgos en la misma edición de la revista Ciencia. Gallo afirmó que un virus que su grupo había aislado de un paciente de SIDA fue sorprendentemente similar en forma a otra virus linfotrópico T humano (HTLV) su grupo había sido el primero en aislar. El grupo de Gallo llamó su recién aislado virus HTLV-III. Al mismo tiempo, el grupo de Montagnier aisló un virus de un paciente que se presenta con hinchazón de la ganglios linfáticos del cuello y debilidad física, dos síntomas clásicos de SIDA. En contradicción con el informe del grupo de Gallo, Montagnier y sus colegas demostraron que las proteínas principales de este virus fueron inmunológicamente diferentes de las de HTLV-I. Grupo de Montagnier nombrado su virus asociado a la linfadenopatía aislado virus (LAV). Como estos dos virus resultaron ser el mismo, en 1986, LAV y HTLV-III se renombró VIH.
Orígenes
Ambos se cree que el VIH-1 y VIH-2 que se originó en no humano primates en West-África central y se han trasladado a los humanos (un proceso conocido como zoonosis) a principios del siglo 20. VIH-1 parece tener su origen en el sur de Camerún a través de la evolución de los SIV (cpz), un virus de la inmunodeficiencia del simio (SIV) que infecta salvajes chimpancés (VIH-1 desciende desde el endémica SIVcpz en la subespecie de chimpancé Pan troglodytes troglodytes). El pariente más cercano del VIH-2 es SIV (SMM), un virus de la mangabey tiznado (atys Cercocebus atys), un viejo mono mundial que vive en África litoral oeste (desde el sur de Senegal hasta el oeste de Costa de Marfil ). Monos del Nuevo Mundo, como la mono búho son resistentes a la infección VIH-1, posiblemente debido a una genómico fusión de dos genes de resistencia viral. Se cree que el VIH-1 que han saltado la barrera de especie en al menos tres ocasiones separadas, dando lugar a los tres grupos de virus, M, N, y O.
Hay pruebas de que los seres humanos que participan en actividades de carne de animales silvestres, ya sea como cazadores o como vendedores de carne de caza, comúnmente adquieren SIV. Sin embargo, SIV es un virus débil, y por lo general se suprime por el sistema inmune humano dentro de semanas de la infección. Se cree que varias transmisiones del virus de persona a persona en una sucesión rápida son necesarios para permitir tiempo suficiente para mutar en VIH. Por otra parte, debido a su relativamente baja tasa de transmisión de persona a persona, sólo puede extenderse a lo largo de la población en la presencia de uno o más de los canales de transmisión de alto riesgo, que se cree que han estado ausentes en África antes del siglo 20 .
Canales de transmisión específicas propuestas de alto riesgo, lo que permite que el virus se adaptan a los seres humanos y se extendió por toda la sociedad, dependen del calendario propuesto para el cruce de animal a humano. Los estudios genéticos del virus sugieren que el ancestro común más reciente del grupo M del VIH-1 se remonta a alrededor del año 1910. Los defensores de este enlace que data de la epidemia del VIH con la aparición de el colonialismo y el crecimiento de las grandes ciudades africanas coloniales, lo que lleva a los cambios sociales, incluyendo un mayor grado de promiscuidad sexual, la difusión de la prostitución, y la alta frecuencia concomitante de enfermedades ulcerosas genitales (tales como sífilis) en las ciudades coloniales nacientes. Si bien las tasas de transmisión del VIH durante las relaciones sexuales vaginales son bajos en circunstancias normales se incrementan muchas veces si uno de los socios sufre de una infección de transmisión sexual que resulta en úlceras genitales. Principios de 1900 ciudades coloniales fueron notables debido a su alta prevalencia de las úlceras genitales de prostitución y en la medida en que a partir de 1928 hasta el 45% de las mujeres residentes en el este de Kinshasa se cree que han sido prostitutas ya partir de 1933 en torno al 15% de todos los residentes de la misma ciudad fueron infectados por una de las formas de sífilis.
Una visión alternativa sostiene que las prácticas médicas peligrosas en África durante los años posteriores a la Segunda Guerra Mundial, como la reutilización de jeringas no estériles de un solo uso durante la vacunación masiva, las campañas de tratamiento con antibióticos y anti-malaria, eran el vector inicial que permitió que el virus de adaptarse a los seres humanos y propagación.
El caso más antiguo documentado de VIH en un ser humano se remonta a 1959 en el Congo . El virus puede haber estado presente en los Estados Unidos desde 1966.
