
Ácido acético
Sobre este escolas selecção Wikipedia
Esta seleção Wikipedia está offline disponível a partir de Crianças SOS, para distribuição no mundo em desenvolvimento. Patrocinar crianças ajuda crianças no mundo em desenvolvimento para aprender também.
| Ácido acético | |
|---|---|
 |  |
Ácido acético, ácido etanóico | |
Outros nomes Acetil hidróxido (AcOH), acetato de hidrogênio (CAH), ácido etílico, ácido Methanecarboxylic | |
| Identificadores | |
| Número CAS | 64-19-7 |
| PubChem | 176 |
InChI
| |
| Propriedades | |
| Fórmula molecular | CH3COOH |
| Massa molar | 60,05 g / mol |
| Aparência | Líquido ou cristais incolores |
| Densidade | 1,049 g · cm -3 ( l ) 1,266 g · cm -3 ( s ) |
| Ponto de fusão | 16,5 ° C (289,6 K, 61,6 ° F) |
| Ponto de ebulição | 118,1 ° C (K 391,2, 244,5 ° F) |
| Solubilidade em água | Totalmente miscível |
| Acidez (p Ka) | 4,76 a 25 ° C |
| Viscosidade | 1.22 mPa.s a 25 ° C |
| Estrutura | |
| Momento de dipolo | 1.74 D (gás) |
| Perigos | |
| MSDS | MSDS External |
| Frases R | R10, R35 |
| Frases-S | (S1 / 2), S23, S26, S45 |
| NFPA 704 |  2 2 2 |
| Ponto de centelha | 43 ° C |
| Os compostos relacionados | |
| Relacionado com o ácido carboxílico | ácido fórmico , ácido propiónico, ácido butírico |
| Os compostos relacionados | acetamida, acetato de etilo, cloreto de acetilo, anidrido acético, acetonitrilo, acetaldeído, etanol , ácido tioacético, acetilcolina, acetilcolinesterase |
| Página Suplementar dados | |
| Estrutura e Propriedades | N, ε r, etc. |
| Termodinâmica dados | Comportamento de fase Sólido, líquido, gasoso |
| Os dados espectrais | UV, IV, RMN , MS |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
Ácido acético, também conhecido como ácido etanóico, é um composto químico orgânico melhor reconhecido para dar vinagre seu sabor amargo e odor pungente. A sua fórmula estrutural é representada como CH3COOH. Pura, água livre de ácido acético (ácido acético glacial) é um gás incolor líquido que atrai a água a partir do ambiente ( hygroscopy), e congela abaixo de 16,7 ° C (62 ° F) para um líquido incolor cristalino sólido . Acético ácido é corrosivo , e seu vapor causa irritação dos olhos, um nariz seco e queima, dor de garganta e congestão para os pulmões. É um ácido fraco porque a a temperatura e pressão padrão ácido dissociado existe em equilíbrio com a forma não dissociada em aquosas soluções , em contraste com ácidos fortes, os quais são completamente dissociados.
O ácido acético é um dos mais simples ácidos carboxílicos (a segunda mais simples, ao lado de ácido fórmico ). É um importante reagente químico e química industrial que é usado na produção de tereftalato de polietileno usado principalmente em garrafas de refrigerantes; acetato de celulose, principalmente para filme fotográfico; e acetato de polivinilo para madeira cola, bem como as fibras sintéticas e tecidos. Nos domicílios ácido acético diluído é frequentemente usado em agentes de descalcificação. No ácido acético indústria de alimentos é usada sob o código de aditivo alimentar E260 como um regulador de acidez.
A demanda global de ácido acético é de cerca de 6,5 milhões toneladas por ano (Mt / a), dos quais cerca de 1,5 Mt / a é cumprida através da reciclagem; o restante é fabricado a partir de matérias-primas petroquímicas ou a partir de fontes biológicas.
Nomenclatura
O trivial ácido acético nome é o nome mais comumente usado e oficialmente preferido pelo IUPAC. Este nome deriva acetum, o Latin palavra para o vinagre. O ácido etanóico é sinónimo de um nome sistemático que é utilizado em apresentações de nomenclatura química.
Ácido acético glacial é um nome trivial de ácido acético isento de água. Semelhante ao alemão nome Eisessig (literalmente, gelo-vinagre), o nome vem dos cristais de gelo do tipo que forma um pouco abaixo da temperatura ambiente a 16,7 ° C (cerca de 62 ° F).
A abreviação mais comum e oficial para o ácido acético é AcOH ou HOAc onde Ac representa o acetil grupo CH 3 -C (= O) - ;. No contexto de reacções ácido-base a abreviatura HAc é muitas vezes utilizado em vez em que Ac representa o acetato de ânion (CH 3 COO -), embora este uso é considerado por muitos como enganosa. Em ambos os casos, o AC não deve ser confundida com a abreviatura para o elemento químico actinium .
O ácido acético tem a fórmula empírica CH2O e a fórmula molecular C 2 H 4 O 2 ou HC 2 H 3 O 2 (para enfatizar o papel do hidrogénio "activo" para formar o sal de acetato de sódio). Para melhor reflectir a sua estrutura, o ácido acético é muitas vezes escrito como -CO 2 CH 3 H, CH 3, COOH, CH 3 CO 2 H, ou HOCOCH 3. O ião resultante da perda de H + a partir de ácido acético é o anião de etilo. O acetato de nome também pode se referir a um sal contendo este ânion, ou um éster de ácido acético.
História

O vinagre é pelo menos tão antiga quanto a civilização. Bactérias produtoras de ácido acético estão presentes por todo o mundo, e as culturas praticando o infusão de cerveja ou vinho , inevitavelmente, descobriu vinagre como o resultado natural da sua exposição ao ar.
O uso de ácido acético em alquimia se estende para a antiguidade. No século 3 aC, o grego filósofo Theophrastos descreveu como vinagre agiu em metais para produzir pigmentos úteis na arte, incluindo o chumbo branco ( carbonato de chumbo) e verdete, uma mistura verde de cobre sais incluindo acetato de cobre (II). Antigos romanos fervido azedou vinho em vasos de chumbo para produzir um xarope muito doce chamado sapa. Sapa era rica em acetato de chumbo, uma substância doce chamado também açúcar de chumbo ou de açúcar Saturno, o que contribuiu para envenenamento por chumbo entre a aristocracia romana.
No século 8, a Alquimista muçulmano Jabir Ibn Hayyan (Geber) foi o primeiro a se concentrar a partir de ácido acético do vinagre através de destilação . No Renascimento , ácido acético glacial foi preparado através do destilação seca de acetatos de metais. O século 16 alemão alquimista Andreas Libavius descrito um tal procedimento, e comparou o ácido acético glacial produzido por esse meio, a vinagre. A presença de água em vinagre tem um efeito profundo sobre as propriedades do ácido acético que durante séculos químicos acreditava que o ácido acético glacial e o ácido encontrado em vinagre foram duas substâncias diferentes. O químico francês Pierre Adet provou que eles sejam idênticos.
Em 1847, o químico alemão Hermann Kolbe sintetizado a partir de ácido acético inorgânicos materiais para a primeira vez. Esta sequência de reacções consistiu de de cloração dissulfureto de carbono para o tetracloreto de carbono , seguido pela a pirólise tetracloroetileno e cloração aquosa de ácido tricloroacético, e concluiu com eletrolítico redução de ácido acético.

Em 1910, o ácido acético glacial foi obtido mais do "licor pirolenhoso" da destilação de madeira. O ácido acético foi isolado a partir deste por meio de tratamento com leite de cal, e o resultante acetato de cálcio foi então acidificada com ácido sulfúrico para recuperar o ácido acético. Neste momento a Alemanha estava produzindo 10.000 toneladas de ácido acético glacial, cerca de 30% do que foi utilizado para o fabrico de corante índigo.
Propriedades químicas
O átomo de hidrogénio (H) no grupo carboxilo (-COOH) em ácidos carboxílicos , tais como ácido acético pode ser emitida como um ião H + ( do protão ), dando-lhes o seu carácter ácido. O ácido acético é um fraco, eficazmente ácido monoprótico em solução aquosa, com um pK um valor de 4,8. Sua base conjugada é acetato de (CH 3 COO -). Um 1.0 Solução H (sobre a concentração de vinagre doméstico) tem um pH de 2,4, o que indica que apenas 0,4% das moléculas de ácido acético são dissociados.

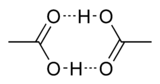
A estrutura de cristal de ácido acético mostra que as moléculas de emparelhar-se em dímeros ligados por ligações de hidrogênio. Os dímeros também pode ser detectado na forma de vapor a 120 ° C. Eles também ocorrer na fase líquida em soluções diluídas em dissolventes não-hidrogénio de ligação, e em certa medida em ácido acético puro, mas são interrompidos por solventes de hidrogénio por entrelaçamento. A entalpia de dissociação do dimero é estimado em 65,0-66,0 kJ / mol, e a entropia de dissociação em 154-157 J mol -1 K -1. Este comportamento dimerização é partilhada por outros ácidos carboxílicos inferiores.
Líquido de ácido acético é um hidrofílico ( polar) solvente prótico, semelhantes a etanol e água . Com um moderado constante dieléctrica de 6,2, pode dissolver-se não apenas os compostos polares, tais como sais inorgânicos e açúcares , mas também compostos não-polares, tais como óleos e elementos tais como enxofre e iodo . É prontamente mistura com outros polares e não-polares, solventes tais como água, clorofórmio, e hexano. Este estabelecimento de dissolução e miscibilidade de ácido acético faz com que seja um produto químico industrial amplamente utilizado.
As reacções químicas
O ácido acético é corrosiva para os metais incluindo ferro , magnésio , e zinco , formando hidrogénio gás e sais de metal chamado acetatos. de alumínio , quando expostas ao oxigénio, forma uma fina camada de óxido de alumínio na sua superfície que é relativamente resistente, de modo que os tanques de alumínio pode ser usado para o transporte de ácido acético. Acetatos de metal também pode ser preparado a partir de ácido acético e uma adequada base, como no popular " bicarbonato de sódio + reação vinagre ". Com a notável exceção de de crómio (II) acetato, quase todos os acetatos são solúveis em água.

O ácido acético sofre as típicas reacções químicas de um ácido carboxílico , por exemplo água e produzir um metal quando se faz reagir com etanoato álcalis, produzindo um etanoato de metal, quando feito reagir com um metal, e produzir um metal etanoato, água e dióxido de carbono quando se faz reagir com carbonatos e hidrogenocarbonatos. O mais notável de todas as suas reacções é a formação de etanol por redução, e formação de derivados, tais como cloreto de acetilo através substituição acilo nucleofílica. Outros derivados incluem substituição anidrido acético; este anidrido é produzido pela perda de água a partir de duas moléculas de ácido acético. Ésteres do ácido acético pode também ser formada através Estéril icação de Fischer, e amidas também pode ser formado. Quando aquecidos acima de 440 ° C, decompõe-se o ácido acético para produzir o dióxido de carbono e metano , ou para produzir ceteno e água.
O ácido acético pode ser detectado pelo seu cheiro característico. A reacção de coloração para os sais de ácido acético é o cloreto de ferro (III) da solução, que resulta em uma cor vermelha profunda que desaparece após acidificação. Acetatos quando aquecida com forma trióxido de arsênio cacodilo óxido, que pode ser detectada pela sua vapores malcheirosos.
Produção

O ácido acético é produzido sinteticamente e por tanto bacteriana fermentação. Hoje, a rota biológica representa apenas cerca de 10% da produção mundial, mas continua a ser importante para a produção de vinagre, como as leis de pureza alimentar mundial estipulam que o vinagre usado em alimentos deve ser de origem biológica. Cerca de 75% de ácido acético feitos para uso na indústria química é feita por meio de metanol carbonilação, explicado abaixo. Métodos alternativos representam o resto.
A produção total mundial de ácido acético virgem é estimada em 5 Mt / a (milhões de toneladas por ano), cerca de metade do que é produzido no Estados Unidos . Europeu de produção é de aproximadamente 1 Mt / um e está a diminuir, e 0,7 Mt / a é produzido no Japão . Outros 1,5 Mt são recicladas a cada ano, trazendo o mercado mundial total para 6,5 Mt / a. Os dois maiores produtores de ácido acético são virgem Celanese e BP Chemicals . Outros grandes produtores incluem Millennium Chemicals, Sterling Chemicals, Samsung, Eastman, e Svensk Etanolkemi.
Metanol carbonila�o
Ácido acético mais virgem é produzido por carbonilação de metanol. Neste processo, o metanol e o monóxido de carbono reagem para produzir ácido acético, de acordo com a equação química:
- CH3OH + CO → CH3COOH
O processo envolve iodometano como um intermediário, e ocorre em três passos. Um catalisador , geralmente um metal complexo, é necessária para a carbonilação (passo 2).
- (1) CH 3 OH + HI → CH 3 I + H2O
- (2) CH3I + CO → CH3 COI
- (3) CH 3 COI + H2O → CH3COOH + HI
Alterando as condições do processo, anidrido acético pode também ser produzido na mesma planta. Porque ambos metanol e monóxido de carbono são matérias-primas matérias-primas, metanol carbonilação longo parecia ser um método atraente para a produção de ácido acético. Henry Drefyus em Celanese britânico desenvolveu uma planta piloto carbonilação de metanol já em 1925. No entanto, a falta de materiais práticos que poderiam conter a mistura de reacção corrosiva na parte alta pressões necessárias (200 atm ou mais) desencorajado comercialização destas rotas. O primeiro processo metanol carbonila�o comercial, que usou um cobalto catalisador, foi desenvolvido pela empresa química alemã BASF em 1963. Em 1968, um ródio baseados catalisador (cis - [Rh (CO) 2 I 2] -), foi descoberto que pode operar de forma eficiente a uma menor pressão com quase nenhum subprodutos. A primeira planta usando este catalisador foi construído por US empresa de produtos químicos Monsanto em 1970, e catalisada por ródio metanol carbonila�o tornou-se o método dominante de produção de ácido acético (ver Processo de Monsanto). No final de 1990, a empresa de produtos químicos BP Chemicals comercializado a Catalisador cativa ([Ir (CO) 2 I 2] -), que é promovida por ruténio . Este irídio processo é -catalysed mais ecológica e mais eficiente e tem largamente suplantado o processo Monsanto, muitas vezes nas mesmas instalações de produção.
Oxidação de acetaldeído
Antes da comercialização do processo Monsanto, a maioria do ácido acético foi produzido por oxidação de acetaldeído. Este continua a ser o segundo método de fabrico mais importante, embora não é competitivo com metanol carbonilação. O acetaldeído pode ser produzido através oxidação de butano ou nafta leve, ou por hidratação de etileno.
Quando butano ou luz nafta é aquecida com ar na presença de vários metais iões , incluindo os de manganês , cobalto e crómio ; peróxidos formulário e, em seguida, se decompõem para produzir ácido acético de acordo com o equação química
- 2 C 4 H 10 + 5 O 2 → 4 CH3COOH + 2 H2O
Tipicamente, a reacção é realizada a uma combinação de temperatura e pressão concebido para estar tão quente quanto possível enquanto mantendo ainda o butano um líquido. As condições reaccionais típicas são 150 ° C e 55 atm. Produtos secundários podem também formar, incluindo butanona, acetato de etilo, ácido fórmico , e ácido propiónico. Estes produtos secundários são também comercialmente valiosos, e as condições de reacção podem ser alterados para produzir mais deles, se esta é economicamente útil. No entanto, a separação do ácido acético a partir desses subprodutos aumenta o custo do processo.
Sob condições semelhantes e semelhantes usando catalisadores que são utilizados para a oxidação butano, acetaldeído pode ser oxidado pelo oxigénio no ar para produzir ácido acético
- 2 CH 3 CHO + O2 → 2 CH3COOH
Utilizando catalisadores modernos, esta reacção pode ter um rendimento de ácido acético maior que 95%. Os principais produtos secundários são acetato de etilo, ácido fórmico , e formaldeído, todos os quais têm menores pontos de ebulição do que o ácido acético e são facilmente separados por destilação .
Oxidação de etileno
O acetaldeído pode ser preparado a partir de etileno por meio da Wacker processo, e depois oxidado como acima. Mais recentemente uma conversão de estágio único mais barata de etileno para ácido acético foi comercializado pela empresa química Showa Denko, que abriu uma planta de etileno na oxidação Ōita, Japão , em 1997. O processo é catalisado por um paládio catalisador de metal suportado numa heteropoli�ido tal como ácido tungstosilicic. Pensa-se ser competitivo com carbonilação do metanol, para as instalações mais pequenas (100-250 kt / a), em função do preço local de etileno.
Fermentação oxidativo
Para a maior parte da história da humanidade, o ácido acético, sob a forma de vinagre, tem sido feita por bactérias do ácido acético do género Acetobacter. Dado oxigénio suficiente, estas bactérias pode produzir vinagre a partir de uma variedade de produtos alimentares alcoólicas. Alimentos comumente usados incluem cidra da maçã , vinho , e fermentado de grãos , malte, arroz ou batata mashes. A reacção química global facilitada por estas bactérias é:
- C 2 H 5 OH + O2 → CH3COOH + H2O
A solução de álcool diluído inoculados com Acetobacter e mantidos em um ambiente aconchegante, arejado lugar vai se tornar vinagre ao longo de alguns meses. Métodos de tomada de vinagre industriais acelerar este processo, melhorando o fornecimento de oxigênio para as bactérias.
Os primeiros lotes de vinagre produzido por fermentação provavelmente seguido erros na processo de vinificação. Se Deve é fermentado a uma temperatura demasiado elevada, Acetobacter irá submergir a levedura que ocorre naturalmente na uvas. Como a demanda para o vinagre para fins culinários, médicas e sanitárias aumento, Vintners rapidamente aprendeu a usar outros materiais orgânicos para produzir vinagre nos meses quentes de verão antes de as uvas estavam maduras e prontas para a transformação em vinho. Este método foi lento, no entanto, e nem sempre bem sucedida, como os viticultores não entender o processo.
Uma das primeiras modernos processos comerciais era o "método rápido" ou "método alemão", praticado na Alemanha, em primeiro 1823. Neste processo, realiza-se a fermentação em uma torre de enchimento ou com aparas de madeira carvão vegetal. O alimento que contém o álcool é escorreu para o topo da torre, e fresco o ar fornecido a partir da parte inferior pela natural ou forçada convecção. O fornecimento de ar melhorado nesse processo o tempo de corte para preparar a vinagre de meses ou semanas.
Mais vinagre hoje é feita no tanque imergido cultura, descrita pela primeira vez em 1949 por Otto Hromatka e Heinrich Ebner. Neste método, o álcool é fermentado de vinagre em um tanque agitado continuamente, e o oxigénio é fornecido fazendo borbulhar ar através da solução. Usando aplicações modernas deste método, o vinagre de ácido acético a 15% pode ser preparada em somente 24 horas em processo descontínuo, mesmo 20% em 60 h de processo fed-batch.
Fermentação anaeróbica
Espécies de bactérias anaeróbias, incluindo membros do gênero Clostridium, pode converter açúcares em ácido acético directamente, sem o uso de etanol como um intermediário. A reacção química global conduzida por estas bactérias pode ser representada como:
- C 6 H 12 O 6 → 3 CH3COOH
Mais interessante do ponto de vista de um químico industrial, estes bactérias acetogénicas pode produzir ácido acético a partir de compostos de um carbono, incluindo metanol , monóxido de carbono , ou uma mistura de dióxido de carbono e hidrogénio :
- 2 CO 2 + 4H 2 → CH3COOH + 2 H2O
Esta capacidade de Clostridium de utilizar açúcares diretamente, ou para produzir ácido acético a partir de insumos menos onerosos, significa que estas bactérias poderiam potencialmente produzir ácido acético de forma mais eficiente do que o etanol-oxidantes como Acetobacter. No entanto, as bactérias Clostridium são menos ácido-tolerante do que Acetobacter. Até mesmo as estirpes de Clostridium ácido mais tolerantes podem produzir vinagre de apenas um por cento de ácido acético poucas, em comparação com estirpes de Acetobacter que podem produzir vinagre de ácido acético até 20%. Actualmente, continua a ser mais rentável para a produção de vinagre usando Acetobacter do que para produzi-lo usando Clostridium e, em seguida, concentrar-lo. Como resultado, embora as bactérias acetog�icas são conhecidos desde 1940, a sua utilização industrial permanece confinado a algumas aplicações de nicho.
Aplicações

O ácido acético é um produto químico reagente para a produção de compostos químicos. A sua maior utilização isolada de ácido acético é na produção de acetato de vinilo monômero, seguido de perto por anidrido acético e produção de ésteres. O volume de ácido acético usado no vinagre é comparativamente pequena.
Monômero de acetato de vinila
A principal utilização de ácido acético é para a produção de monômero de acetato de vinila (VAM). Esta aplicação consome aproximadamente 40% a 45% da produção mundial de ácido acético. A reacção é de etileno e de ácido acético com oxigénio durante um paládio catalisador .
- 2 H 3 C-COOH + 2 C 2 H 4 + O 2 → 2 H 3 C-CO-O-CH = CH2 + 2 H2O
O acetato de vinilo pode ser polimerizado para acetato de polivinilo ou de outros Os polímeros, que são aplicados em tintas e adesivos.
Produção de Ester
O prefeito ésteres de ácido acético são comumente utilizados para solventes tintas, tintas e revestimentos. Os ésteres incluem acetato de etilo, n- acetato de butilo, acetato de isobutilo, e acetato de propilo. Elas são tipicamente produzidas por catalisada reacção de ácido acético e o correspondente álcool . : H 3 C-COOH + HO-R → H 3 C-CO-OR + H 2 O, em que R = um general grupo alquilo
A maior parte dos ésteres de acetato, no entanto, são produzidos a partir de acetaldeído usando o Tishchenko reação. Além disso, acetatos de éteres são utilizados como solventes para nitrocelulose, lacas acrílicas, removedores de esmaltes e manchas de madeira. Primeira monoéteres de glicol são produzidos a partir de óxido de etileno ou óxido de propileno com álcool, que são então esterificados com ácido acético. Os três produtos principais são o etileno acetato de éter monoetílico de dietilenoglicol (EEA), etileno-glicol éter monobutílico de etilo (EBA), e propileno glicol monometil éter acetato (PMA). Esta aplicação consome cerca de 15% a 20% de ácido acético em todo o mundo. Acetatos de éteres, por exemplo EEE, foram mostrados para ser prejudicial para a reprodução humana.
Anidrido acético
O produto de condensação de duas moléculas de ácido acético é anidrido acético. A produção mundial de anidrido acético é uma aplicação importante, e utiliza cerca de 25% a 30% da produção mundial de ácido acético. O anidrido acético pode ser produzido directamente por metanol carbonilação ignorando o ácido, e Plantas Cativá pode ser adaptado para a produção de anidrido.

O anidrido acético é um forte agente de acetilação. Como tal, a sua principal aplicação é a acetato de celulose, um material sintético têxtil também utilizado para filme fotográfico. O anidrido acético é também um reagente para a produção de aspirina , heroína, e outros compostos.
Vinagre
Na forma de vinagre, soluções de ácido acético (ácido acético, tipicamente 5% a 18%, sendo a percentagem calculada geralmente em massa) são utilizados directamente como um condimento, e também no conservação de vegetais e outros produtos alimentares. Vinagre de mesa tende a ser mais diluída (5% a 8% de ácido acético), enquanto decapagem comercial de alimentos emprega geralmente soluções mais concentradas. A quantidade de ácido acético utilizado como vinagre em escala mundial não é grande, mas historicamente, este é, de longe, a aplicação mais antiga e bem conhecida.
Uso como solvente
Ácido acético glacial é um excelente polar solvente prótico, tal como referido acima . É freqüentemente usado como solvente para a recristalização, para purificar compostos orgânicos. Ácido acético puro fundido é utilizado como um solvente na produção de ácido tereftálico (TPA), a matéria-prima para tereftalato de polietileno (PET). Embora atualmente responsável por 5% a 10% do uso de ácido acético em todo o mundo, esta aplicação específica deverá crescer significativamente na próxima década, o aumento da produção de PET.
O ácido acético é geralmente utilizado como um solvente para as reacções que envolvam carbocátions, tal como Friedel-Crafts alquilação. Por exemplo, uma etapa no fabrico comercial de sintético cânfora envolve Rearranjo de canfeno para acetato de isobornilo Wagner-Meerwein; aqui o ácido acético actua como um solvente e como um nucleófilo para interceptar o carbocation rearranjado. O ácido acético é o solvente de escolha quando redução de um arilo -nitro a um grupo anilina usando paládio-sobre-carbono.
Ácido acético glacial é utilizado em química analítica para a estimativa de substâncias fracamente alcalinas, tais como amidas orgânicas. Ácido acético glacial é um muito mais fraco de base de água, de modo a amida comporta-se como uma base forte neste meio. Ele pode então ser titulada utilizando uma solução em ácido acético glacial de um ácido forte, tal como ácido perclórico.
Outras aplicações
As soluções diluídas de ácido acético são também utilizados para a sua ligeira acidez . Exemplos do ambiente doméstico incluem a utilização de um parar banho durante o desenvolvimento de películas fotográficas, e em agentes de descalcificação para remover calcário das torneiras e chaleiras. A acidez também é usado para tratar a picada da água-viva caixa desativando as células urticantes da água-viva, prevenção de lesões graves ou morte se aplicado imediatamente, e para o tratamento infecções do ouvido externo em pessoas em preparações como Vosol. De forma equivalente, o ácido acético é usado como um spray-on conservante para o gado silagem, para desencorajar bacteriana e fúngica de crescimento. Ácido acético glacial, também é usado como um e verruga removedor de verruga.
Os sais orgânicos ou inorgânicos são produzidos a partir de ácido acético, incluindo:
- Acetato de sódio, usado no têxtil e indústria como um alimento conservante ( E262).
- O cobre (II) etilo, usado como um pigmento e um fungicida.
- Acetato de alumínio e ferro (II) utilizados como acetato- mordentes para corantes.
- Paládio (II) acetato de etilo, usado como um catalisador para reacções de acoplamento orgânicos, tais como o Reacção de Heck.
- Acetato de prata, utilizado como um pesticida.
Ácidos acéticos substituídos produzidas incluem:
- Ácido monocloroacético (MCA), ácido dicloroacético (considerada um subproduto), e ácido tricloroacético. MCA é utilizado no fabrico de corante índigo.
- Ácido bromoacético, que é esterificado para produzir o reagente bromoacetato de etilo.
- Ácido trif luoroacético, o que é um reagente comum no síntese orgânica.
As quantidades de ácido acético utilizado nestas outras aplicações em conjunto (para além do TPA) conta durante mais 5% -10% de utilização de ácido acético em todo o mundo. Estas aplicações são, no entanto, não deve crescer tanto quanto a produção de TPA.
Segurança
Ácido acético concentrado é corrosivo e deve ser manuseado com cuidado apropriado, uma vez que pode causar queimaduras na pele, danos permanentes nos olhos e irritação para as mucosas. Estas queimaduras ou bolhas podem não aparecer até horas após a exposição. As luvas de látex não oferecem protecção, luvas de modo especialmente resistentes, tais como aqueles feitos de borracha nitrílica, deve ser usado quando manusear o composto. Ácido acético concentrado pode ser inflamada com dificuldade no laboratório. Torna-se um risco inflamável se a temperatura ambiente for superior a 39 ° C (102 ° F), e pode formar misturas explosivas com o ar acima desta temperatura ( limites de explosão: 5,4% -16%).
Os perigos de soluções de ácido acético dependem da concentração. A tabela a seguir lista o Classificação da UE de soluções de ácido acético:

| Concentração por peso | Molarity | Classificação | Frases-R |
|---|---|---|---|
| 10% -25% | 1,67-4,16 mol / L | Irritante (Xi) | R36 / 38 |
| 25% -90% | 4,16-14,99 mol / L | Corrosivo (C) | R34 |
| > 90% | > 14,99 mol / L | Corrosivo (C) | R10, R35 |
Soluções em ácido acético mais do que 25% são tratadas num exaustor de fumos, devido à pungente, vapores corrosivos. Dilui-se ácido acético, sob a forma de vinagre, é inofensivo. No entanto, a ingestão de soluções mais fortes é perigoso para a vida humana e animal. Ela pode causar graves danos ao sistema digestivo, e uma mudança potencialmente letal na acidez do sangue .
Devido à incompatibilidade, recomenda-se manter a distância de ácido acético ácido crômico, etileno glicol, ácido nítrico , ácido perclórico, permanganatos, e peróxidos hidroxilas.
