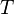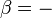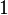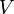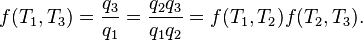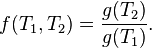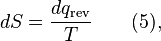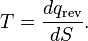Temperatura termodinámica
Antecedentes de las escuelas de Wikipedia
SOS Children hizo esta selección Wikipedia junto a otros recursos de escuelas . Haga clic aquí para obtener más información sobre SOS Children.
| Termodinámica | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 La clásica Máquina de Carnot. | |||||||||||||||||||||
Ramas
| |||||||||||||||||||||
Sistemas Estado
Procesos
Ciclos
| |||||||||||||||||||||
Propiedades del sistema
Funciones de estado ( Variables conjugadas en cursiva)
| |||||||||||||||||||||
Propiedades materiales
| |||||||||||||||||||||
Ecuaciones
| |||||||||||||||||||||
Potenciales
| |||||||||||||||||||||
Filosofía
Historia
Teorías
Publicaciones clave
Líneas de tiempo
Arte
Educación
| |||||||||||||||||||||
Los científicos
| |||||||||||||||||||||
Temperatura termodinámica es la medida absoluta de la temperatura y es uno de los principales parámetros de la termodinámica .
Temperatura termodinámica es un "absoluto" escala, ya que es la medida de la temperatura subyacente propiedad fundamental: su nula o punto cero, cero absoluto , es la temperatura a la que los componentes de partículas de materia tienen movimiento mínimo y pueden llegar a ser no más frío.
En su forma más simple, la temperatura se debe a la energía cinética de los movimientos vibratorios de la materia de partículas constituyentes ( moléculas , átomos , y partículas subatómicas). La variedad completa de estos movimientos cinéticos, junto con las posibles energías de las partículas, y también de vez en cuando algunos otros tipos de energía de las partículas en equilibrio con estos, contribuyen al total energía interna dentro de una sustancia. La energía interna es vagamente llama el calor o energía energía térmica en condiciones cuando no hay trabajo se hace sobre la sustancia de su entorno, o por la sustancia en los alrededores. La energía interna puede ser almacenada en un número de maneras dentro de una sustancia, pero sólo la energía cinética de las partículas aumenta la temperatura de la sustancia.
Visión de conjunto
Surge de la temperatura de las vibraciones submicroscópicas aleatorias de los componentes de partículas de materia . Estos movimientos comprenden la cinética de la energía en una sustancia. Más específicamente, la temperatura termodinámica de cualquier cantidad a granel de la materia es la medida de la energía cinética media de un cierto tipo de movimiento de vibración de sus partículas constituyentes llamados movimientos de traslación. Movimientos de traslación son, los movimientos de todo el cuerpo ordinarias en . el espacio por el que las partículas se mueven y se transfieren energía en colisiones tridimensional Figura 1 abajo muestra el movimiento de traslación en los gases; Figura 4 muestra el movimiento de traslación en los sólidos. De temperatura termodinámica punto nulo, cero absoluto, es la temperatura a la que los constituyentes de las partículas de la materia son tan cerca como sea posible para completar resto; es decir, que tienen mínimo movimiento, manteniendo sólo la mecánica cuántica movimiento. Cero energía cinética permanece en una sustancia en el cero absoluto (véase La energía térmica en el cero absoluto , más adelante).
En todo el mundo científico en el que las mediciones se realizan en Unidades del SI, temperatura termodinámica se mide en grados Kelvin (símbolo: K). Muchos campos de la ingeniería en la Estados Unidos sin embargo, medir la temperatura termodinámica mediante el Escala Rankine.
Por acuerdo internacional, el kelvin unidad y su escala se definen por dos puntos: cero absoluto, y la punto de triples Vienna Standard Mean Océano agua (agua con una mezcla específica de isótopos de hidrógeno y oxígeno). El cero absoluto, la temperatura más baja posible, se define como siendo precisamente 0 K y -273,15 ° C . La punto triple del agua se define como siendo precisamente 273,16 K y 0,01 ° C. Esta definición hace tres cosas:
- Se fija la magnitud de la unidad kelvin como, precisamente, 1 parte en 273,16 partes de la diferencia entre el cero absoluto y el punto triple del agua;
- Se establece que uno kelvin tiene precisamente la misma magnitud que un incremento de un grado en la Celsius escala; y
- Establece la diferencia entre los puntos nulos los dos escalas 'por ser precisamente 273,15 grados Kelvin (0 K = -273,15 ° C y 273,16 K = 0,01 ° C).
Las temperaturas se expresan en grados Kelvin se convierten en grados Rankine simplemente multiplicando por 1,8 el siguiente: T ° R = 1.8 T K, donde K T y T ° R son las temperaturas en grados kelvin y Rankine respectivamente. Las temperaturas se expresan en grados Rankine se convierten en grados Kelvin dividiendo por 1,8 de la siguiente manera: T K = T ° R / 1.8.
Realización práctica
Aunque las escalas Kelvin y Celsius se definen utilizando el cero absoluto (0 K) y el punto triple del agua (273,16 K y 0,01 ° C), no es práctico para utilizar esta definición a temperaturas que son muy diferentes desde el punto triple del agua. ITS-90 es entonces diseñado para representar la temperatura termodinámica lo más estrechamente posible en toda su gama. Se requieren muchos diseños diferentes termómetro para cubrir toda la gama. Estos incluyen helio termómetros de presión de vapor, los termómetros de gas helio, Los termómetros de resistencia de platino estándar (conocidos como Sprts, PRT o Platium RTD) y termómetros de radiación monocromática.
Para algunos tipos de termómetro de la relación entre la propiedad observada (por ejemplo, la longitud de una columna de mercurio) y de la temperatura, es casi lineal, por lo que para la mayoría de los fines de una escala lineal es suficiente, sin calibración, punto por punto. Para otros se requiere una curva de calibración o ecuación. El termómetro de mercurio, inventado antes de la temperatura termodinámica se entendía, originalmente definido la escala de temperatura; su linealidad hizo lecturas se correlacionan bien con la temperatura real, es decir, la escala de temperatura "mercurio" se adecuaba a la verdadera escala.
La relación de la temperatura, los movimientos, la conducción, y la energía de calor

La naturaleza de la energía cinética, el movimiento de traslación, y la temperatura
En su forma más simple, la temperatura se debe a la energía cinética de los movimientos vibratorios de la materia de partículas constituyentes ( moléculas , átomos , y partículas subatómicas). La variedad completa de estos movimientos cinéticos, junto con las posibles energías de las partículas, y también de vez en cuando algunos otros tipos de energía de las partículas en equilibrio con estos, contribuyen al total energía interna (sin apretar, el calor de la energía) dentro de una sustancia. Así, la energía interna puede ser almacenado en un número de maneras dentro de una sustancia, pero sólo la energía cinética de las partículas aumenta la temperatura de la sustancia. La capacidad de calor, que se refiere entrada de calor y el cambio de temperatura, se discute a continuación.
La relación de la energía cinética, la masa y la velocidad está dada por la fórmula E k = 1/2 mv 2. En consecuencia, las partículas con una unidad de masa en movimiento en una unidad de la velocidad tienen precisamente la misma energía cinética, y precisamente la misma temperatura, como aquellos con cuatro veces la masa, pero la mitad de la velocidad.
Excepto en el régimen cuántico a temperaturas extremadamente bajas, la temperatura termodinámica de cualquier cantidad mayor de una sustancia (una cantidad estadísticamente significativa de partículas) es directamente proporcional a la energía cinética media media de un tipo específico de movimiento de las partículas conocido como movimiento de traslación. Estos movimientos simples en los tres x, y, z y dimensiones eje y del espacio: las partículas se mueven en los tres espacial grados de libertad. Esta forma particular de la energía cinética se refiere a veces como la temperatura cinética. movimiento de traslación no es sino una forma de energía de calor y es lo que da los gases no sólo su temperatura, sino también su presión y la gran mayoría de su volumen. Esta relación entre la temperatura, la presión, y el volumen de los gases es establecida por el fórmula pV de la ley de los gases ideales = nRT y se materializa en la leyes de los gases.
La medida en que la energía cinética del movimiento de traslación de un átomo individual o molécula (de partículas) en un gas contribuye a la presión y el volumen de gas que es una función proporcional de temperatura termodinámica según lo establecido por la Constante de Boltzmann (símbolo: k B). La constante de Boltzmann se refiere también la temperatura termodinámica de un gas a la energía cinética media de movimiento de traslación de una partícula individual como sigue:
donde:
 es la energía cinética media en joules (J) y se pronuncia "bar E"
es la energía cinética media en joules (J) y se pronuncia "bar E" - k B = 1,380 6 504 (24) × 10 -23 J / K y se pronuncia "abeja sub Kay"
- T es la temperatura termodinámica en grados Kelvin (K) y se pronuncia "Tee"
Mientras que la constante de Boltzmann es útil para encontrar la energía cinética media de una partícula, es importante tener en cuenta que, incluso cuando una sustancia se aísla y en equilibrio termodinámico (todas las partes están a una temperatura uniforme y sin calor va dentro o fuera de ella), los movimientos de traslación de los átomos y moléculas individuales se produce a través de una amplia gama de velocidades (ver la animación en la Figura 1 arriba). En cualquier instante, la proporción de partículas que se mueven a una velocidad dada dentro de este rango se determina por la probabilidad como se describe por el Distribución de Maxwell-Boltzmann. El gráfico que se muestra aquí en la fig. La figura 2 muestra la distribución de velocidad de 5.500 K átomos de helio. Tienen una velocidad más probable de 4,780 kilometros / s. Sin embargo, una cierta proporción de átomos en cualquier instante dado se están moviendo más rápido, mientras que otros se están moviendo de forma relativamente lenta; algunos son momentáneamente en un virtual (fuera del eje x hacia la derecha). Este gráfico utiliza la velocidad inversa por su eje x de modo que la forma de la curva puede ser fácilmente comparado con las curvas de la Figura 5 a continuación. En ambos gráficos, cero en el eje x representa la temperatura infinita. Además, las x y eje y en ambos gráficos se escalan proporcionalmente.
Las altas velocidades de movimiento de traslación
Aunque se requiere un equipo muy especializado de laboratorio para detectar directamente movimientos de traslación, las colisiones resultantes de átomos o moléculas con pequeñas partículas suspendidas en un fluido produce El movimiento browniano que puede ser visto con un microscopio ordinario. Los movimientos de traslación de las partículas elementales son muy rápidos y se requieren temperaturas cercanas al cero absoluto de observar directamente. Por ejemplo, cuando los científicos en el NIST alcanzó una temperatura fría récord de 700 nK (mil millonésimas de kelvin) en 1994, utilizaron equipos láser red óptica para adiabáticamente fresco cesio átomos. A continuación, apagados los láseres de atrapamiento y velocidades atómicas medidos directamente de 7 mm por segundo con el fin de calcular su temperatura. Las fórmulas para calcular la velocidad y la velocidad de movimiento de traslación se dan en la siguiente nota al pie.
Los movimientos internos de las moléculas y calor específico

Hay otras formas de energía de calor además de la energía cinética del movimiento de traslación. Como se puede ver en la animación de la derecha, las moléculas son objetos complejos; son una población de átomos y agitación térmica puede tensar sus internos enlaces químicos de tres maneras diferentes: a través de la rotación, longitud de enlace, y el vínculo movimientos angulares. Estos son todos los tipos de grados de libertad internos. Esto hace que las moléculas distinta de sustancias monoatómicos (que consisten en átomos individuales) como el los gases nobles helio y argón , que tienen sólo los tres grados de libertad de traslación. La energía cinética se almacena en grados de libertad internos, lo que les da una temperatura interna moléculas. A pesar de que estos movimientos se llaman interna, las partes externas de las moléculas se mueven aún-más bien como el balanceándose de un estacionario globo de agua. Esto permite el intercambio bidireccional de energía cinética entre movimientos internos y movimientos de traslación con cada colisión molecular. Por consiguiente, en forma de calor se retira a partir de moléculas, tanto su temperatura cinética (la energía cinética del movimiento de traslación) y su temperatura interna disminuyen simultáneamente en proporciones iguales. Este fenómeno se describe por la teorema de equipartición, que establece que para cualquier cantidad mayor de una sustancia en el equilibrio, la energía cinética del movimiento de las partículas se distribuye uniformemente entre todos los grados de libertad activos disponibles para las partículas. Puesto que la temperatura interna de las moléculas son generalmente igual a su temperatura cinética, la distinción es por lo general de interés sólo en el estudio detallado de no equilibrio termodinámico (LTE) fenómenos locales como combustión, el sublimación de sólidos, y el difusión de los gases calientes en un vacío parcial.
La energía cinética almacenada internamente en las moléculas de las sustancias a causa contienen más energía de calor a cualquier temperatura dada y para absorber la energía de calor adicional para un incremento de temperatura dado. Esto se debe a que cualquier energía cinética, es decir, en un instante dado, encuadernado en movimientos internos no está en ese mismo instante que contribuye a movimientos de traslación de las moléculas. Esta energía cinética adicional simplemente aumenta la cantidad de energía térmica absorbe una sustancia para un aumento de la temperatura dada. Esta propiedad se conoce como una sustancia de capacidad de calor específico.
Diferentes moléculas absorben diferentes cantidades de energía térmica para cada aumento de la temperatura; es decir, que tienen diferentes capacidades caloríficas específicas. Surge de alta capacidad de calor específico, en parte, porque las moléculas de ciertas sustancias »poseen grados de libertad internos más que otros. Por ejemplo, a temperatura ambiente de nitrógeno , que es una molécula diatómica, tiene cinco grados de libertad activos: el movimiento de traslación de tres que comprende además de dos grados de libertad de rotación internamente. No es sorprendente que, de acuerdo con el teorema de equipartición, nitrógeno tiene cinco tercios de la capacidad de calor específico por mol (un número específico de moléculas) como lo hacen los gases monoatómicos. Otro ejemplo es gasolina (véase cuadro con su calor específico). La gasolina puede absorber una gran cantidad de energía calorífica por mol con sólo un cambio de temperatura modesta debido a que cada molécula comprende un promedio de 21 átomos y por lo tanto tiene muchos grados de libertad internos. Incluso los más grandes, las moléculas más complejas pueden tener decenas de grados de libertad internos.
La difusión de la energía térmica: Entropía, fonones, y electrones de conducción móviles

La conducción del calor es la difusión de la energía térmica de las partes calientes de un sistema de frío. Un sistema puede ser o bien una entidad mayor sola o una pluralidad de entidades discretas a granel. El término mayor en este contexto significa una cantidad estadísticamente significativa de partículas (que puede ser una cantidad microscópica). Siempre que la energía calorífica se difunde dentro de un sistema aislado, las diferencias de temperatura dentro de la disminución del sistema (y entropía aumenta).
Uno de los mecanismos de conducción de calor especial se produce cuando el movimiento de traslación, la temperatura subyacente movimiento de las partículas, se transfiere el impulso de partícula a partícula en colisiones. En los gases, estos movimientos de traslación son de la naturaleza se muestra arriba en la figura. 1 . Como se puede ver en que la animación, no sólo impulso (calor) difusa en todo el volumen del gas a través de colisiones de serie, pero las moléculas o átomos enteras pueden avanzar en un nuevo territorio, con lo que su energía cinética con ellos. En consecuencia, las diferencias de temperatura igualan a lo largo gases muy rápidamente, sobre todo para los átomos o moléculas de luz; convección acelera este proceso aún más.
Movimiento de traslación en sólidos sin embargo, toma la forma de fonones (véase la Fig. 4 a la derecha). Fonones están limitados, paquetes de ondas cuantificadas que viajan a la velocidad del sonido para una sustancia dada. La manera en que interactúan dentro de fonones un sólido determina una variedad de sus propiedades, incluyendo su conductividad térmica. En los sólidos eléctricamente aislantes, a base de fonones conducción de calor es generalmente ineficaz y dichos sólidos se consideran aislantes térmicos (tales como vidrio, plástico, caucho, cerámica, y la roca). Esto se debe a que en los sólidos, los átomos y las moléculas están bloqueados en su lugar en relación con sus vecinos y no son libres de vagar.
Metales sin embargo, no se limitan a sólo basado fonón-conducción de calor. La energía térmica lleva a cabo a través de metales extraordinariamente rápido porque en lugar de colisiones directas-molécula a molécula, la gran mayoría de la energía térmica es mediada a través de muy ligeras, conducción móviles electrones . Es por esto que existe una correlación casi perfecta entre los metales ' conductividad térmica y su conductividad eléctrica. Electrones de conducción imbuyen metales con su extraordinaria conductividad porque son deslocalizado (es decir, no ligado a un átomo específico) y se comportan más bien como una especie de gas cuántico debido a los efectos de energía de punto cero (para más información sobre ZPE, ver Nota 1). Además, los electrones son relativamente ligeros con una masa en reposo sólo 1/1836 ésimo la de un protón . Esto es aproximadamente la misma proporción que una 0.22 bala Corto (29 granos o 1,88 g) en comparación con el rifle que le dispara. Como Isaac Newton escribió con su tercera ley del movimiento ,
Ley # 3: Todas las fuerzas se presentan en pares, y estas dos fuerzas son iguales en magnitud y opuesta en dirección.
Sin embargo, una bala acelera más rápido que un rifle dado una fuerza igual. Desde energía cinética aumenta con el cuadrado de la velocidad, casi toda la energía cinética entra en la bala, no el fusil, a pesar de que ambos experimentan la misma fuerza de los gases propulsores en expansión. De la misma manera, porque son mucho menos masiva, la energía térmica se confirma fácilmente por electrones de conducción móviles. Además, debido a que están deslocalizados y muy rápido, la energía cinética del calor lleva a cabo muy rápidamente a través de los metales con abundantes electrones de conducción.
La difusión de la energía de calor: radiación Negro-cuerpo
La radiación térmica es un subproducto de las colisiones que surgen de varios movimientos de vibración de los átomos. Estas colisiones causan los electrones de los átomos a los emiten térmicas fotones (conocido como la radiación del cuerpo negro). Los fotones son emitidos en cualquier momento una carga eléctrica se acelera (como sucede cuando las nubes electrónicas de dos átomos chocan). Incluso las moléculas individuales con temperaturas internas superiores a cero absoluto también emiten radiación del cuerpo negro de sus átomos. En cualquier cantidad mayor de una sustancia en el equilibrio, los fotones de cuerpo negro se emiten a través de una gama de longitudes de onda en un espectro que tiene una curva en forma de campana como el llamado Curva de Planck (ver gráfico de la Fig. 5 a la derecha). La parte superior de una curva de Planck ( la longitud de onda máxima emitancia) está situado en una parte particular de la espectro electromagnético, dependiendo de la temperatura del cuerpo negro. Sustancias en extrema temperaturas criogénicas emiten en longitudes de onda de radio de largo mientras que temperaturas extremadamente calientes producen corto rayos gamma (véase la Tabla de temperaturas comunes ).
La radiación del cuerpo negro se difunde energía térmica a través de una sustancia, ya que los fotones son absorbidos por átomos vecinos, transfiriendo impulso en el proceso. Fotones de cuerpo negro también se escapan fácilmente de una sustancia y pueden ser absorbidas por el entorno ambiental; la energía cinética se pierde en el proceso.
Según lo establecido por la Ley de Stefan-Boltzmann, la intensidad del negro-cuerpo aumenta la radiación como la cuarta potencia de la temperatura absoluta. Por lo tanto, un cuerpo negro a 824 K (poco menos de brillante color rojo opaco) emite 60 veces el radiantes poder como lo hace a 296 K (temperatura ambiente). Es por esto que se puede tan fácilmente sentir el calor radiante de objetos calientes a distancia. A temperaturas más altas, tales como las que se encuentran en una lámpara incandescente, la radiación del cuerpo negro puede ser el principal mecanismo por el cual la energía de calor se escapa un sistema.
Tabla de temperaturas termodinámicas
La gama completa de la escala de temperatura termodinámica, desde el cero absoluto a absoluta caliente, y algunos puntos notables entre ellos se muestran en la tabla de abajo.
| kelvin | Luminosidad del Pico longitud de onda de fotones cuerpo negro | |
| Absolutamente nada (Precisamente por definición) | 0 K | ∞ |
| Medido más frío temperatura | 450 pK | 6400 kilómetros |
| Uno millikelvin (Precisamente por definición) | 0.001 K | 2.897 77 metros (Radio, FM banda) |
| Agua de punto triple (Precisamente por definición) | 273,16 K | 10,608.3 nm (Longitud de onda larga IR) |
| Lámpara incandescente B | 2500 K | 1160 nm (Near infrarrojos) C |
| De Sun superficie visible C | 5778 K | 501,5 nm ( luz verde ) |
| Perno del relámpago canal | 28.000 K | 100 nm (Far Ultraviolet luz) |
| Núcleo de Sun | 16 MK | 0,18 nm ( Rayos X) |
| Arma termonuclear (Temperatura pico) | 350 MK | 8.3 × 10 -3 nm ( Los rayos gamma) |
| Sandia National Labs ' Z máquina D | 2 GK | 1,4 × 10 -3 nm (rayos gamma) |
| Core de un alta masa la estrella en su último día | 3 GK | 1 × 10 -3 nm (rayos gamma) |
| Binario Fusión neutrón sistema de la estrella | 350 GK | 8 × 10 -6 nm (rayos gamma) |
| Estallido de rayos gamma progenitores | 1 CT | 3 × 10 -6 nm (rayos gamma) |
| Relativamente Pesados Ion Collider | 1 CT | 3 × 10 -6 nm (rayos gamma) |
| Protones del CERN vs. colisiones núcleo | 10 TK | 3 × 10 -7 nm (rayos gamma) |
| Universo 5,391 × 10 -44 s después del Big Bang | 1,417 × 10 32 K | 1,616 × 10 -26 nm (Frecuencia de Planck) |
A El valor de K 2500 es aproximada.
B Para un verdadero cuerpo negro (que no son filamentos de tungsteno). Emisividad tungsteno filamentos 'es mayor en longitudes de onda más cortas, lo que hace que parezcan más blancos.
C de temperatura de la fotosfera eficaz.
D Para un verdadero cuerpo negro (que el plasma no lo era). Emisión dominante del máquina Z se originó a partir de 40 electrones MK (emisiones de rayos X blandos) en el plasma.
El calor de los cambios de fase

La energía cinética del movimiento de las partículas es sólo un contribuyente a la energía total de calor en una sustancia; otro es transiciones de fase, que son la energía potencial de los enlaces moleculares que se pueden formar en una sustancia cuando se enfría (como durante condensación y congelación). La energía térmica requerida para una transición de fase se llama . calor latente Este fenómeno más fácilmente puede ser captada por teniendo en cuenta que en la dirección inversa: calor latente es la energía requerida para romper enlaces químicos (tales como durante evaporación y de fusión). Casi todo el mundo está familiarizado con los efectos de las transiciones de fase; por ejemplo, vapor a 100 ° C puede causar quemaduras graves mucho más rápido que el aire 100 ° C a partir de una secador de pelo. Esto ocurre porque una gran cantidad de calor latente se libera en forma de vapor se condensa en agua líquida en la piel.
A pesar de que la energía térmica es liberada o absorbida durante las transiciones de fase, puros elementos químicos , compuestos , y eutéctica aleaciones exhiben ningún cambio de temperatura en absoluto, mientras que se someten a ellos (véase la Fig. 7, abajo a la derecha). Considere la posibilidad de un tipo particular de transición de fase: fusión. Cuando un sólido se está derritiendo, red cristalina enlaces químicos se rompen; la sustancia está en la transición de lo que se conoce como un estado más ordenado a un estado menos ordenada. En la Fig. 7, la fusión del hielo se muestra en el cuadro inferior izquierdo en dirección de azul a verde.

En un punto termodinámico específico, el punto de fusión (que es de 0 ° C a través de un amplio rango de presión en el caso de agua), todos los átomos o moléculas son, en promedio, en el umbral de energía máximo sus enlaces químicos puede resistir sin romper de la celosía. Los enlaces químicos son fuerzas de todo o nada: o se aferran, o se rompen; no hay un estado en el medio. En consecuencia, cuando una sustancia se encuentra en su punto de fusión, cada julio de energía de calor añadido sólo rompe los lazos de una cantidad específica de sus átomos o moléculas, convirtiéndolos en un líquido de precisamente la misma temperatura; ninguna energía cinética se añade a movimiento de traslación (que es lo que da sustancias su temperatura). El efecto es más bien como palomitas de maíz: a una cierta temperatura, la energía de calor adicional no puede hacer que los granos más caliente hasta que la transición (apareciendo) es completa. Si el proceso se invierte (como en la congelación de un líquido), la energía de calor debe ser retirado de una sustancia.
Como se mencionó anteriormente, la energía térmica necesaria para una transición de fase se llama calor latente. En los casos específicos de fusión y de congelación, se llama entalpía de fusión o calor de fusión. Si los enlaces moleculares en una red cristalina son fuertes, el calor de fusión puede ser relativamente grande, típicamente en el intervalo de 6 a 30 kJ por mol para el agua y la mayor parte de los elementos metálicos. Si la sustancia es uno de los gases monoatómicos, (que tienen poca tendencia a formar enlaces moleculares) el calor de fusión es más modesto, que van desde 0,021 hasta 2,3 kJ por mol. En términos relativos, las transiciones de fase pueden ser eventos verdaderamente energéticos. Para derretir completamente hielo a 0 ° C en agua a 0 ° C, hay que añadir aproximadamente 80 veces la energía térmica como se requiere para aumentar la temperatura de la misma masa de agua líquida en un grado Celsius. Proporciones de los metales son aún mayores, típicamente en el intervalo de 400 a 1200 veces. Y la transición de fase de ebullición es mucho más enérgico que la congelación. Por ejemplo, la energía necesaria para hervir por completo o vaporizar el agua (lo que se conoce como entalpía de vaporización) es aproximadamente 540 veces la requerida para un aumento de un grado.
Entalpía considerable del agua de vaporización es por eso que uno de piel puede quemarse tan rápido como el vapor se condensa en él (partida de rojo a verde en la Fig. 7 supra). En la dirección opuesta, es por esto que su piel se siente fresca como el agua líquida en la que se evapora (un proceso que se produce en un sub-ambiente temperatura de bulbo húmedo que es dependiente humedad relativa). Entalpía altamente energético del agua de vaporización es también un factor importante que subyace por qué cubiertas solares de la piscina (flotantes, mantas aislantes que cubren piscinas cuando no esté en uso) son tan eficaces en la reducción de los costos de calefacción: evitan la evaporación. Por ejemplo, la evaporación de sólo 20 mm de agua de una piscina de 1,29 metros de profundidad enfría el agua de 8,4 grados Celsius (15,1 ° F).
Energía interna
La energía total cinética de todo movimiento de las partículas, incluido el de los electrones de conducción, además de la energía potencial de los cambios de fase, además de energía de punto cero comprenden la energía interna de una sustancia, que es su energía total de calor. La energía interna término no debe confundirse con grados de libertad internos. Mientras que los grados de libertad internos de las moléculas se refiere a un lugar concreto al que se dirige la energía cinética, la energía interna de una sustancia comprende todas las formas de energía térmica.

La energía térmica en el cero absoluto
Como una sustancia se enfría, las diferentes formas de energía de calor y sus efectos relacionados disminuir simultáneamente en magnitud: el calor latente de las transiciones de fase disponibles son liberados como una sustancia pasa de un estado menos ordenada a un estado más ordenado; los movimientos de traslación de los átomos y moléculas disminuyen (su temperatura cinética disminuye); los movimientos internos de moléculas disminuyen (su temperatura interna disminuye); electrones de conducción (si la sustancia es un conductor eléctrico) viajar algo más lento; y el pico de la radiación del cuerpo negro emitancia longitud de onda aumenta (la energía de los fotones disminuye). Cuando las partículas de una sustancia están tan cerca como sea posible para completar resto y retener sólo el movimiento mecánico cuántico inducido por ZPE, la sustancia está a la temperatura del cero absoluto (T = 0).
Tenga en cuenta que mientras que el cero absoluto es el punto cero de temperatura termodinámica y es también el punto en el que los constituyentes de las partículas de la materia tienen mínimo movimiento, el cero absoluto no es necesariamente el punto en el que una sustancia contiene energía térmica cero; hay que ser muy preciso con lo que uno entiende por energía térmica. A menudo, todos los cambios de fase que pueden ocurrir en una sustancia, se han producido en el momento en que llegue a cero absoluto. Sin embargo, este no es siempre el caso. En particular, T = 0 helio permanece líquido a presión ambiente y debe estar bajo una presión de al menos 25 bar (2,5 MPa) a cristalizar. Esto se debe a que el calor del helio de la fusión (la energía necesaria para fundir helio hielo) es tan bajo (sólo 21 julios por mol) que el efecto que provoca el movimiento de la energía de punto cero es suficiente para evitar que se congele a presiones más bajas. Sólo si es menor de al menos 25 bar (2,5 MPa) de presión esta energía de calor latente se libera como congelaciones de helio mientras se aproximaba al cero absoluto. Una complicación adicional es que muchos sólidos cambian su estructura de cristal para arreglos más compactos a presiones extremadamente altas (hasta millones de bares, o cientos de gigapascales). Estos son conocidos como transiciones de fase sólido-sólido en el que el calor latente es liberada como una red cristalina cambia a un termodinámicamente más favorable, una compacta.
Las complejidades anteriores hacen de las generalizaciones más engorrosos en cuanto a la energía interna en T = 0 sustancias. Independientemente de la presión, sin embargo, lo que puede decirse es que en el cero absoluto, que todos los sólidos con una red cristalina de menor energía tales aquellos con un disposición de apilamiento más compacto (ver Fig. 8, arriba izquierda) contiene energía interna mínima, manteniendo sólo que debido a la siempre presente de fondo de energía de punto cero. Se puede decir también que para una sustancia dada a presión constante, el cero absoluto es el punto más bajo de la entalpía (una medida del potencial de trabajo que se lleva a la energía interna, presión y volumen en consideración). Por último, siempre es cierto que todos los T = 0 sustancias contienen energía térmica cinética cero.
Aplicaciones prácticas de temperatura termodinámica

Temperatura termodinámica es útil no sólo para los científicos, sino que también puede ser útil para laicos en muchas disciplinas con los gases. Al expresar las variables en términos absolutos y la aplicación de Ley de Gay-Lussac de proporcionalidad temperatura / presión, las soluciones a los problemas cotidianos son sencillos; por ejemplo, el cálculo de cómo un cambio de temperatura afecta la presión dentro de un neumático de automóvil. Si el neumático tiene una presión relativamente frío de 200 kPa-Gage, a continuación, en términos absolutos (en relación con el vacío), su presión es 300 kPa-absoluta. La temperatura ambiente ("frío" en términos de neumáticos) es 296 K. Si la presión del neumático es de 20 ° C más caliente (20 grados Kelvin), la solución se calcula como 316 K / 296 K = 6,8% mayor temperatura termodinámica y la presión absoluta; es decir, una presión de 320 kPa-absoluto, que es 220 kPa-Gage.
Definición de temperatura termodinámica
Estrictamente hablando, la temperatura de un sistema está bien definidas únicamente si sus partículas ( átomos , moléculas , electrones , fotones ) están en de equilibrio, de modo que sus energías obedecen a una Distribución de Boltzmann (o su mecánica cuántica contraparte). Hay muchas escalas posibles de temperatura, derivados de una variedad de observaciones de los fenómenos físicos. La temperatura termodinámica puede ser demostrado que tiene propiedades especiales y, en particular, puede ser visto para ser definida de forma única (hasta algún factor multiplicativo constante), considerando la eficiencia de idealizada motores térmicos. Así, el T 2 / T 1 de dos temperaturas T 1 y T 2 relación es la misma en todas las escalas absolutas.
Sin apretar declaró, temperatura controla el flujo de calor entre dos sistemas, y el universo en su conjunto, como con cualquier sistema natural, tiende a progresar con el fin de maximizar la entropía . Esto sugiere que debe haber una relación entre la temperatura y la entropía. Para dilucidar esto, en primer lugar considerar la relación entre el calor, el trabajo y la temperatura. Una manera de estudiar este es analizar un motor de calor, que es un dispositivo para la conversión de calor en trabajo mecánico, tal como la Máquina de Carnot. Tales funciones de un motor térmico mediante el uso de un gradiente de temperatura entre una alta temperatura T H y una baja temperatura T C para generar trabajo, y el trabajo realizado (por ciclo, por ejemplo) por el motor de calor es igual a la diferencia entre la energía de calor q H poner en el sistema a la temperatura elevada y el calor q C expulsado a la temperatura baja (en ese ciclo). La eficiencia del motor es el trabajo dividido por el calor puesto en el sistema o
donde w cy es el trabajo realizado por ciclo. Así, la eficiencia depende sólo de q C / q H .
El teorema de Carnot establece que todos los motores reversibles que operan entre los mismos depósitos de calor son igualmente eficientes.Por lo tanto, cualquier motor de calor reversible que opera entre las temperaturasT 1yT 2debe tener la misma eficiencia, es decir, la eficiencia es la función de sólo temperaturas
Además, un motor de calor reversible que opera entre las temperaturas T 1 y T 3 debe tener la misma eficiencia como uno que consta de dos ciclos, uno entre T 1 y otro (intermedio) la temperatura T 2 , y la segunda entre T 2 y T 3 . Una forma rápida de ver esto es que si este no fuera el caso, entonces la energía (en forma de Q ) se desperdicia o ganado, lo que resulta en diferentes eficiencias globales cada vez que un ciclo se divide en ciclos de componentes; claramente un ciclo puede estar compuesto de cualquier número de ciclos más pequeños.
Con esta comprensión deQ 1,Q 2yQ 3, observamos también que matemáticamente,
Pero la primera función es NO en función de T 2 , por lo tanto, el producto de las dos últimas funciones DEBE resultar en la eliminación de T 2 como una variable. Por tanto, la única manera es definir la función f como sigue:
y
de modo que
es decir la relación de intercambio de calor es una función de las respectivas temperaturas a las que se producen. Podemos elegir cualquier función monótona para nuestra 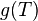 ;se trata de una cuestión de conveniencia y convenciones que elegimos
;se trata de una cuestión de conveniencia y convenciones que elegimos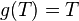 .Elegir entoncesunatemperatura de referencia fijo (es decir, el punto triple del agua), se establece la escala de temperatura termodinámica.
.Elegir entoncesunatemperatura de referencia fijo (es decir, el punto triple del agua), se establece la escala de temperatura termodinámica.
Es de señalar que tal definición coincide con la de la derivación gas ideal; También es esta definición de la temperatura termodinámica que nos permite representar la eficiencia de Carnot en términos de T H y T C , y de ahí se deriva que el (completo) ciclo de Carnot es isentrópico:
Sustituyendo esta de nuevo en nuestra primera fórmula de la eficiencia se obtiene una relación en términos de temperatura:
Observe que para T C = 0 la eficiencia es 100% y que la eficiencia se hace mayor que 100% para T C <0, que los casos no son realistas. Restando el lado derecho de la ecuación 4 de la porción media y reordenando da
donde el signo negativo indica calor expulsado del sistema.La generalización de esta ecuación esteorema de Clausius, lo que sugiere la existencia de unafunción de estadoS(es decir, una función que depende sólo del estado del sistema, no en la forma en que llegó a ese estado) definido (hasta una constante aditiva) por
donde el subíndice indica la transferencia de calor en un proceso reversible. La función S corresponde a la entropía del sistema, mencionado anteriormente, y el cambio de S alrededor de cualquier ciclo es cero (como es necesario para cualquier función de estado). Ecuación 5 puede reordenarse para obtener una definición alternativa para la temperatura en función de la entropía y el calor (para evitar bucle lógica, debemos primero definir la entropía a través de la mecánica estadística):
Para un sistema en el que la entropíaSes una funciónS(E) de su energíaE, la temperatura termodinámicaTestá, por tanto, dada por
de modo que el recíproco de la temperatura termodinámica es la tasa de aumento de la entropía con la energía.
Historia
- Ca. 485 aC: Parménides en su tratado "Sobre la naturaleza" postuló la existente de frigidum primum , una fuente de sustancia elemental hipotética de todas refrigeración o frío en el mundo.
- 1702-1703: Guillaume Amontons (1663-1705) publicó dos artículos que se pueden utilizar a él crédito por ser el primer investigador para deducir la existencia de un (termodinámico) escala de temperatura fundamental que ofrece un cero absoluto. Él hizo el descubrimiento mientras esforzándose por mejorar los termómetros de aire en uso en ese momento. Sus termómetros J-tubo compuestas de una columna de mercurio que fue apoyada por una masa fija de aire atrapado dentro de la parte sensible del termómetro. En términos termodinámicos, sus termómetros de confiar en la relación volumen / temperatura del gas bajo presión constante. Sus mediciones del punto de agua y el punto de fusión del hielo de ebullición mostraron que, independientemente de la masa de aire atrapado dentro de sus termómetros o el peso de mercurio el aire estaba apoyando, la reducción en el volumen de aire en el punto de hielo era siempre la misma proporción . Esta observación le llevó a postular que una reducción suficiente de la temperatura reduciría el volumen de aire a cero. De hecho, sus cálculos proyectan que el cero absoluto fue equivalente a -240-sólo C ° 33.15 grados cortas del verdadero valor de -273,15 ° C.
- 1742: Anders Celsius (1701-1744) creó una versión "hacia atrás" de la escala moderna temperatura Celsius. En escala original de Celsius, el cero representa el punto de ebullición del agua y 100 representados el punto de fusión del hielo. En su documento Observaciones de dos grados persistentes en un termómetro, relató sus experimentos que muestran que el punto de fusión del hielo era efectivamente afectado por la presión. También determinó con notable precisión cómo punto de ebullición del agua varió como una función de la presión atmosférica. Propuso que el cero en su escala de temperatura (punto de ebullición del agua) podría ser calibrado a la presión barométrica media al nivel medio del mar.
- 1744: Coincidente con la muerte de Anders Celsius, el famoso botánico Carlos Linneo (1707-1778) invirtió efectivamente la escala de Celsius a la recepción de su primer termómetro con una escala donde cero representa el punto de hielo y 100 punto de ebullición del agua representado fusión. La medida linnaeus-termómetro , para su uso en sus invernaderos, fue hecha por Daniel Ekström, el principal fabricante de instrumentos científicos en el momento de Suecia. Durante los siguientes 204 años, la comunidad científica y termometría en todo el mundo a que se refiere esta escala como la escala centígrada . Las temperaturas en la escala centígrada a menudo se informó simplemente como grados o, cuando se desea una mayor especificidad, grados centígrados . El símbolo de los valores de temperatura en esta escala era ° C (en varios formatos en los últimos años). Debido a que el término centígrados era también el nombre en francés de una unidad de medida angular (una centésima parte de un ángulo recto) y tenía una connotación similar en otros idiomas, se utilizó el término "grado centesimal" cuando el lenguaje muy preciso, inequívoco era requerida por los organismos internacionales de normalización, como la Oficina Internacional de Pesas y Medidas (BIPM). La 9ª CGPM ( Conferencia General de Pesas y Medidas ( Conferencia General de Pesas y Medidas ) y el (CIPM Comité Internacional de Pesas y Medidas ( Comité Internacional de Pesas y Medidas ) adoptó formalmente grados Celsius (símbolo: ° C) en 1948.
- 1777: En su libro Pyrometrie (Berlín: Haude y Spener, 1779) completaron cuatro meses antes de su muerte, Johann Heinrich Lambert (1728-1777), a veces erróneamente denominado Joseph Lambert, propuso una escala de temperatura absoluta basada en la presión / temperatura relación de un volumen fijo de gas. Esto es distinto de la relación volumen / temperatura del gas bajo presión constante que Guillaume Amontons descubierto 75 años antes. Lambert declaró que el cero absoluto fue el punto donde una simple extrapolación de la línea recta alcanza la presión de gas de cero y era igual a -270 ° C.
- Circa 1787: A pesar de la obra de Guillaume Amontons 85 años antes, Jacques Alexandre César Charles (1746-1823) a menudo se le atribuye el descubrimiento, pero no la publicación, que el volumen de un gas a presión constante es proporcional a su temperatura absoluta. La fórmula que creó fue V 1 / T 1 = V 2 / T 2 .
- 1802: Joseph Louis Gay-Lussac (1778-1850) obra publicada (reconociendo las notas de laboratorio inéditos de Jacques Charles quince años antes) que describen cómo el volumen de gas a los cambios de presión constantes linealmente con su absoluta (termodinámica) de temperatura. Este comportamiento se conoce como la ley de Charles y es una de las leyes de los gases. Suyas son las fórmulas primero conocido el uso del número 273 para el coeficiente de expansión del gas con respecto al punto de fusión del hielo (lo que indica que el cero absoluto fue equivalente a -273 ° C).
- 1848: William Thomson , (1824-1907), también conocido como Lord Kelvin, escribió en su papel, en un Absoluto termométrica Escala, de la necesidad de una escala por el cual infinita fría (cero absoluto) fue punto cero de la escala, y que utilizó el grado Celsius por su incremento de unidad. Al igual que Gay-Lussac, Thomson calculó que el cero absoluto fue equivalente a -273 ° C en los termómetros de aire de la época. Esta escala absoluta que hoy se conoce como la escala de temperatura termodinámica Kelvin. Es de destacar que el valor de Thomson, de -273 se deriva realmente de 0,00366, lo cual fue aceptado el coeficiente de expansión de gas por grado Celsius con respecto al punto de hielo. La inversa de -0.00366 expresó a cinco dígitos significativos es -273,22 ° C, que es muy cerca del valor real de -273,15 ° C.
- 1859: William John Macquorn Rankine (1820-1872) propuso una escala de temperatura termodinámica similar a William Thomson, pero que utiliza el grado Fahrenheit por su incremento de unidad. Esta escala absoluta es conocida hoy como la escala de temperatura termodinámica Rankine.
- 1877-1884: Ludwig Boltzmann (1844-1906) hizo importantes contribuciones a la termodinámica a través de una comprensión del papel que la cinética de las partículas y la radiación del cuerpo negro jugado. Su nombre ahora se une a varias de las fórmulas utilizadas hoy en día en la termodinámica.
- Circa 1930:experimentos termometría Gas cuidadosamente calibrados hasta el punto de punto de agua helada y de ebullición de fusión mostró que el cero absoluto fue equivalente a -273,15 ° C.
- 1948: Resolución de 3 de la novena CGPM (Conferencia General de Pesas y Medidas, también conocida como la Conferencia General de Pesas y Medidas) fijó el punto triple del agua precisamente en 0,01 ° C. En este momento, el punto triple todavía tenía ninguna definición formal de su valor kelvin equivalente, que la resolución declarada "se fija en una fecha posterior". La implicación es que si el valor del cero absoluto medido en la década de 1930 fue verdaderamente -273,15 ° C, entonces el punto triple del agua (0,01 ° C) fue equivalente a 273,16 K. Además, tanto el CIPM (Comité Internacional de Pesas y Medidas , también conocido como el Comité Internacional de Pesas y Medidas) y la CGPM adoptó formalmente el nombre centígrados para el grado Celsius y la escala de temperatura Celsius .
- 1954: Resolución de 3 de la 10ª CGPM dio la escala Kelvin su definición moderna eligiendo el punto triple del agua como su segundo punto de definición y le asignó una temperatura de precisión 273,16 kelvin (lo que estaba escrito en realidad 273,16 grados Kelvin en el momento). Esto, en combinación con la Resolución 3 de la novena CGPM, tuvo el efecto de definir el cero absoluto por ser exactamente cero kelvin y -273,15 ° C.
- 1967/1968: Resolución 3 de la CGPM 13 renombró el incremento unidad de temperatura termodinámica kelvin , símbolo K, en sustitución de grado absoluto , símbolo ° K. Además, sintiéndose útil para definir más explícitamente la magnitud del incremento de la unidad, la CGPM 13 también decidió en la Resolución 4 que "El kelvin, unidad de temperatura termodinámica, es la fracción 1 / 273,16 de la temperatura termodinámica del punto triple del agua ".
- 2005:El CIPM (Comité Internacional de Pesas y Medidas, también conocido como elComité Internacional de Pesas y Medidas)afirmó que a los efectos de delinear la temperatura del punto triple del agua, la definición de la escala de temperatura termodinámica Kelvin se referiría a agua que tiene una composición isotópica definida como precisamente igual a la especificación nominal deViena Standard Mean agua del océano.