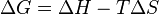Do zero absoluto
Informações de fundo
Crianças SOS têm produzido uma seleção de artigos da Wikipédia para escolas desde 2005. Veja http://www.soschildren.org/sponsor-a-child para saber mais sobre apadrinhamento de crianças.
O zero absoluto é a mais baixa possível temperatura onde nada poderia ser mais frio, e nenhum calor energia permanece em uma substância. Zero absoluto é o ponto em que as moléculas não se mover (em relação ao resto do corpo) mais do que eles são necessários para por um mecânico quântico efeito chamado energia do ponto zero. É um limite teórico e não pode ser alcançado.
Por acordo internacional, zero absoluto é definido precisamente como 0 K no Kelvin escala, o qual é um (absoluta) temperatura termodinâmica escala, e -273,15 ° C no Celsius escala (centígrados). Zero absoluto também é precisamente equivalente a 0 ° R na Escala Rankine (também uma escala de temperatura termodinâmica), e -459,67 ° F no Escala Fahrenheit. Embora não seja possível resfriar qualquer substância a 0 K, os cientistas fizeram grandes avanços na obtenção de temperaturas próximas do zero absoluto, onde exposições de matéria efeitos quânticos tais como supercondutividade e superfluidez. De fato, em 2000, a Helsinki University of Technology relatado que atingem temperaturas de 100 pK (1 × 10 -10 K).
História
Um dos primeiros a discutir a possibilidade de um "frio absoluto" em tal escala foi Robert Boyle , que em 1665 seus novos experimentos e observações que tocam Fria, afirmou o litígio, que é o frigidum primum é muito conhecido entre os naturalistas, alguns sustentando a terra, outros para a água, o ar para os outros, e alguns dos modernos para salitre, mas todos parecendo concordar que:
| " | Há algum corpo ou outro que é da sua própria natureza extremamente frio e pela participação de todos os outros corpos que obter essa qualidade. | " |
Limitar ao "grau de frio"
A questão de saber se existe um limite para o grau de frio possível, e, em caso afirmativo, onde deve ser colocado o zero, foi atacado pela primeira vez pelo físico francês Guillaume Amontons em 1702, no âmbito das suas melhorias no termômetro de ar e temperaturas em seus instrumentos foram indicados pela altura em que uma coluna de mercúrio foi sustentado por uma certa massa de ar, o volume ou a "mola" que, naturalmente, variou de acordo com o calor para o qual foi exposto. Amontons portanto argumentado que o zero do seu termómetro seria a temperatura à qual a mola de ar em que foi reduzida a nada. Na escala ele utilizado, o ponto de ebulição da água foi marcado em 73 e o ponto de fusão do gelo em 51, de modo que o zero da escala foi a equivalente a cerca de -240 na escala de Celsius.
Este notavelmente estreita aproximação com o valor atual de -273,15 ° C para o zero do termômetro de ar foi melhorada em pelo Johann Heinrich Lambert, que deu o valor de -270 ° C e observou que esta temperatura pode ser considerado como frio absoluto.
Os valores dessa ordem para o zero absoluto não foram, no entanto, universalmente aceite sobre este período. Pierre-Simon Laplace e Antoine Lavoisier , em seu tratado sobre 1780 calor, chegou a valores que variam de 1.500 a 3.000 abaixo do ponto de congelamento da água, e pensei que, em qualquer caso, deve ser de pelo menos 600 abaixo. John Dalton em sua Filosofia Chemical deu dez cálculos deste valor, e definitivamente aprovado -3000 ° C como o zero natural da temperatura.
Uma vez que a temperatura é a medida da energia cinética média num sistema, é possível que algumas moléculas de atingir um estado de sem energia cinética, enquanto outros têm mais energia do que a energia cinética medido. Uma vez que a média entre as medidas inferiores e superiores nos dar a temperatura lemos, é bem possível que algumas moléculas para chegar a zero Kelvin.
O trabalho de Lord Kelvin
Depois JP Joule tinha determinado o equivalente mecânico do calor, Lord Kelvin abordou a questão de um ponto de vista totalmente diferente, e em 1848 inventou uma escala de temperatura absoluta que era independente das propriedades de qualquer substância particular e foi baseada unicamente na fundamentais leis da termodinâmica. Seguiu-se a partir dos princípios em que esta escala foi construído que o seu zero foi colocado na -273,150 ° C, em quase exatamente o mesmo ponto como o zero do termômetro de ar.
Informações Adicionais
Pode demonstrar-se a partir das leis da termodinâmica que o zero absoluto nunca pode ser alcançados artificialmente, embora seja possível atingir temperaturas perto de que através da utilização de cryocoolers. Este é o mesmo princípio que assegura que não haverá máquina pode ser de 100% eficiente.
Em temperaturas muito baixas na vizinhança de zero absoluto, a matéria exibe muitas propriedades incomuns, incluindo a supercondutividade , superfluidez, e Condensação de Bose-Einstein. A fim de estudar tais fenômenos, os cientistas têm trabalhado para obter as temperaturas cada vez mais baixos.
- Em 1994, pesquisadores NIST conseguiu uma temperatura fria, em seguida,-recorde de 700 nK (bilionésimos de Kelvin).
- Em Novembro de 2000, as temperaturas de spin nuclear inferiores a 100 pK foram relatados para uma experiência no Helsinki University of Low Temperature Laboratório de Tecnologia. No entanto, esta foi a temperatura de um determinado grau de liberdade-a propriedade quântica chamada spin-não a temperatura termodinâmica média geral nuclear para todos os graus de liberdade possível.
- Em fevereiro de 2003, o Nebulosa boomerang foi encontrado para ser -272,15 ° C; 1 K, o lugar mais frio conhecido fora de um laboratório. O nebulosa é de 5.000 anos-luz da Terra e está na constelação Centaurus.
Termodinâmica próximas do zero absoluto
Em temperaturas próximas de 0 K, movimento quase todos molecular cessa e  S = 0 para qualquer processo adiabático. Substâncias puras podem (idealmente) formar perfeitos cristais como T
S = 0 para qualquer processo adiabático. Substâncias puras podem (idealmente) formar perfeitos cristais como T  0. Max Planck forma forte da 's terceira lei da termodinâmica afirma a entropia de um cristal perfeito desaparece no zero absoluto. No entanto, isso não pode ser verdade, se o estado mais baixo de energia é degenerada, ou mais do que um microstate. O original Teorema de Nernst calor faz a afirmação mais fraca e menos controversa que a variação de entropia para qualquer processo isotérmico se aproxima de zero como T
0. Max Planck forma forte da 's terceira lei da termodinâmica afirma a entropia de um cristal perfeito desaparece no zero absoluto. No entanto, isso não pode ser verdade, se o estado mais baixo de energia é degenerada, ou mais do que um microstate. O original Teorema de Nernst calor faz a afirmação mais fraca e menos controversa que a variação de entropia para qualquer processo isotérmico se aproxima de zero como T  0
0
A implicação é que a entropia de um cristal perfeito simplesmente se aproxima de um valor constante.
O postulado de Nernst identifica o isotérmica T = 0 como coincidente com o adiabat S = 0, embora outros isotérmicas e adiabats são distintos. Como não há duas adiabats cruzam, nenhuma outra pode adiabat cruzam a T = 0 isotérmica. Assim sendo, nenhum processo adiabático iniciada à temperatura diferente de zero podem levar a temperatura de zero. (≈ Callen, pp. 189-190)
Uma afirmação é ainda mais forte que é impossível por qualquer processo de redução a temperatura de um sistema para zero num número finito de operações. (≈ Guggenheim, p. 157)
Um cristal perfeito é aquele em que o interno estrutura de rede se estende ininterrupta em todas as direções. A perfeita ordem pode ser representado por translacional simetria ao longo de três (geralmente não ortogonal) eixos . Cada elemento da rede da estrutura está no seu devido lugar, se se trata de um único átomo ou um agrupamento molecular. Para substâncias que têm dois (ou mais) formas cristalinas estáveis, tais como o diamante e grafite para carbono , existe um tipo de "degenerescência química". A questão que permanece é se ambos podem ter entropia zero em T = 0, embora cada um está perfeitamente ordenado.
Cristais perfeitos nunca ocorrem na prática; imperfeições e materiais amorfos mesmo inteiras, simplesmente se "congeladas em" a baixas temperaturas, assim transições para mais estados estáveis não ocorrem.
Usando o Modelo de Debye, o calor e entropia de um cristal puro específica são proporcionais a T 3, enquanto que a entalpia e potencial químico são proporcionais a T 4. (Guggenheim, p. 111) Estas quantidades cair em direção a seus T = 0 valores limites e abordagem com zero encostas. Para os calores específicos, pelo menos, o próprio valor limite é definitivamente zero, tal como comprovado por experimentos para abaixo de 10 K. Mesmo a menos detalhado Einstein modelo mostra essa queda curioso em calores específicos. Na verdade, todos os calores específicos desaparecer no zero absoluto, e não apenas os de cristais. Da mesma forma para o coeficiente de expansão térmica. Relações de Maxwell mostram que várias outras grandezas também desaparecer. Estes fenômenos foram imprevisto.
Uma vez que a relação entre as mudanças na energia de Gibbs , entalpia e entropia é
Assim, tal como o t diminui, Δ G e H Δ aproximam um do outro (desde que Δ S é limitada). Experimentalmente, verificou-se que todos os processos espontâneos (incluindo reacções químicas ) resultar num decréscimo em G à medida que avançam na direção equilbrium. Se Δ S e / ou T são pequenos, a condição Δ L <0 pode implicar que Δ H <0, o que indica uma reação exotérmica que libera calor. No entanto, isso não é necessário; reacções endotérmicas pode proceder-se espontaneamente, se o termo T Δ S é grande o suficiente.
Mais do que isso, as encostas dos derivados de temperatura de Δ G e H Δ convergem e são iguais a zero no T = 0, o que garante que Δ G e H Δ são quase a mesma ao longo de uma gama considerável de temperaturas, justificando o aproximada empírica Princípio de Thomsen e Berthelot, que diz que o estado de equilíbrio ao qual um sistema procede é a que se desenvolve a maior quantidade de calor, ou seja, um processo real é o mais exotérmica. (Callen, pp. 186-187)
Relação com Bose Einstein
A Bose-Einstein é uma substância que se comporta muito incomum, mas apenas em temperaturas extremamente baixas, talvez alguns bilionésimos acima do zero absoluto. É neste ponto o leis da termodinâmica tornar-se muito importante.
Escalas de temperatura absolutos
Absoluta ou temperatura termodinâmica é convencionalmente medida em kelvins ( Celsius -scaled incrementos), e cada vez mais raramente na Escala Rankine ( Incrementos Fahrenheit-escala). Temperatura absoluta é determinada exclusivamente-se a uma constante multiplicativa que especifica o tamanho do "grau", de modo que as proporções dos dois temperaturas absolutas, T 2 / T 1, são as mesmas em todas as escalas. A definição mais transparente vem da clássica Distribuição ao longo energias, ou a partir dos análogos do quantum de Maxwell-Boltzmann: Estatísticas de Fermi-Dirac (partículas de semi-inteiro rotação) e Estatísticas de Bose-Einstein (partículas de spin inteiro), todos os que dão os números relativos de partículas como (decrescente) funções exponenciais de energia mais de kT. Em um nível macroscópico, uma definição pode ser dada em termos de eficiência de "reversível" motores de calor que opera entre reservatórios térmicos mais quentes e mais frios.
Temperaturas negativas
Certos sistemas semi-isolados, tais como um sistema de não-interagindo gira em um campo magnético, pode atingir temperaturas negativas; no entanto, eles não são realmente mais frio do que zero absoluto. Eles podem no entanto ser considerado como "mais quente do que o t = ∞", como a energia irá fluir a partir de um sistema de temperatura negativo para com qualquer outro sistema de temperatura positivo aquando do contacto.