
Astatine
Acerca de este escuelas selección Wikipedia
Esta selección Wikipedia está disponible sin conexión de SOS Children para su distribución en el mundo en desarrollo. ¿Quieres saber sobre el patrocinio? Ver www.sponsorachild.org.uk
| Astatine | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
85 En | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||
| desconocido, pero probablemente un negro sólido; posiblemente metálico en apariencia | ||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | astato, A, 85 | |||||||||||||||||||||||||||||||||
| Pronunciación | / æ s t ə t yo n / COMO -tə-adolescente o / æ s t ə t ɪ n / COMO -tə-estaño | |||||||||||||||||||||||||||||||||
| Categoría metálico | halógeno clasificada a veces como metaloide (en disputa) | |||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 17 (halógenos) , 6, p | |||||||||||||||||||||||||||||||||
| Peso atómico estándar | (210) | |||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Xe ] 4f 14 5d 10 6s 2 6p 5 2, 8, 18, 32, 18, 7 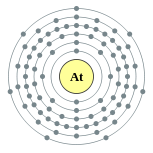 | |||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||
| Descubrimiento | Dale R. Corson, Kenneth Ross MacKenzie, Emilio Segrè (1940) | |||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||
| Punto de fusion | 575 K , 302 ° C, 576 ° F | |||||||||||||||||||||||||||||||||
| Punto de ebullicion | 610 K, 337 ° C, 639 ° F | |||||||||||||||||||||||||||||||||
| El calor de vaporización | (A 2) 54,39 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||
| Estados de oxidación | -1, 1, 3, 5, 7 | |||||||||||||||||||||||||||||||||
| Electronegatividad | 2,2 (escala de Pauling) | |||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 887,7 ± 38,59 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Radio covalente | 150 pm | |||||||||||||||||||||||||||||||||
| Van der Waals radio | 202 pm | |||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | sin datos | |||||||||||||||||||||||||||||||||
| Conductividad térmica | 1,7 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-68-8 | |||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de astato | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
El astato es una radiactivo elemento químico con el símbolo químico Al y número atómico 85. Se produce en la Tierra sólo como el resultado de la desintegración radiactiva de ciertos elementos más pesados. Todos sus isótopos son de corta duración; el más estable es el astato-210, con una vida media de 8,1 horas. En consecuencia, se sabe mucho menos sobre astatine que la mayoría de otros elementos. Las propiedades observadas son consistentes con él que es un análogo más pesado de yodo ; muchas otras propiedades se han estimado sobre la base de esta semejanza.
Astato Elemental nunca ha sido visto, porque una masa lo suficientemente grande como para ser visto (por el ojo humano desnudo) se vaporiza inmediatamente por el calor generado por su propio radiactividad. El astato puede ser oscura, o puede tener una apariencia metálica y ser un semiconductor, o puede ser incluso un metal. Es probable que tenga un punto de fusión mucho más alto que hace yodo, a la par con los de bismuto y el polonio. Químicamente, astato se comporta más o menos como un halógeno , se espera que para formar astatides iónicos con alcalinos o alcalinotérreos metales; se sabe para formar compuestos covalentes con los elementos no metálicos, incluyendo otros halógenos. Lo hace, sin embargo, también tienen una química catiónica notable que lo distingue de los halógenos más ligeros. El segundo más longevo isótopo del astato, astato-211, es el único que tiene actualmente ningún uso comercial, ser empleado en medicina para diagnosticar y tratar algunas enfermedades a través de su emisión de partículas alfa (núcleos de helio-4). Sólo se utilizan cantidades muy pequeñas, sin embargo, debido a su intensa radiactividad.
El elemento fue producido por primera vez por Dale R. Corson, Kenneth Ross MacKenzie, y Emilio Segrè en el Universidad de California en Berkeley en 1940. Lo llamaron el elemento "astatine", un nombre que viene de la gran inestabilidad de la materia sintetizada (la fuente palabra griega αστατος (astatos) significa "inestable"). Tres años más tarde se encuentra en la naturaleza, aunque es el elemento menos abundante en la corteza de la Tierra entre los no- elementos transuránicos, con una cantidad total estimada de menos de 28 gramos (1 onza) en un momento dado. Seis isótopos de astato, con números de masa de 214 a 219, están presentes en la naturaleza como los productos de diversas rutas de desintegración de elementos más pesados, pero ni el isótopo más estable de astato (con número de masa 210), ni astato-211 (que se utiliza en la medicina) se produce de forma natural .
Características
El astato es un elemento extremadamente radiactivos; todos sus isótopos tienen una vida media de menos de 12 horas, en descomposición en el bismuto , el polonio , el radón , u otros isótopos astatine. Entre los primeros 101 elementos en la tabla periódica, sólo francio es menos estable.
Las propiedades de volumen de astato no se conocen con alto grado de certeza. La investigación está limitado por su corta vida media, lo que impide la creación de cantidades ponderables. Una pieza visible de astato sería inmediata y completamente vaporizado por el calor generado por su intensa radiactividad. El astato generalmente se clasifica como un no metal o una metaloide. Sin embargo, la formación de metal para astato de fase condensada también se ha sugerido.
Físico
La mayoría de las propiedades físicas de astato se han estimado (por interpolación o extrapolación), utilizando diversos métodos teóricamente puestas a tierra o derivados empíricamente. Como ejemplo, los halógenos más pesados son más oscuros que son halógenos de peso atómico menor - flúor es casi incoloro, el cloro es de color verde brillante, bromo es de color marrón, y el yodo es gris oscuro / violeta. El astato se describe a veces como un sólido negro (suponiendo que se sigue esta tendencia), o como que tiene un aspecto metálico (si es un metaloide o un metal). Los fusión y puntos de ebullición también se espera de astato seguir la tendencia observada en la serie de los halógenos, que aumenta con el número atómico . Sobre esta base, los puntos de fusión y ebullición se estiman en 575 K (302 ° C; 575 ° F) y 610 K (337 ° C; 638 ° F), respectivamente. Sin embargo, alguna evidencia experimental sugiere astatine puede tener puntos de fusión y ebullición más bajos que los que implica la tendencia halógeno. Sublima astatino con menos facilidad que hace yodo, que tiene un menor presión del vapor. Aun así, la mitad de una cantidad dada de astato se vaporizará en una hora si se pone sobre una superficie de vidrio limpio en temperatura ambiente.
La estructura cristalina de astato sólido es desconocido. La evidencia a favor (o en contra) de la existencia de astato diatómico (A 2) es escasa y no concluyente. Algunas fuentes afirman que A 2 no existe, o por lo menos nunca se ha observado, mientras que otras fuentes afirman o implican su existencia. A pesar de esta controversia, muchas propiedades de astato diatómico se han pronosticado.
Químico
Muchas de las propiedades químicas de astato se han determinado utilizando estudios de seguimiento sobre soluciones extremadamente diluidas astatine. Propiedades más conocidos - como la formación del anión - están en línea con otros halógenos. Sin embargo, astato tiene algunas características metálicas, así como enchapado en un cátodo, coprecipitación con sulfuros de metal en ácido clorhídrico, y la formación de un catión en soluciones ácidas fuertes.
El astato tiene una electronegatividad de 2,2 en la escala de Pauling revisado. Esto es menor que la de yodo (2,66) y el mismo que el de hidrógeno. Sin embargo, en astatide hidrógeno (HAT) la carga negativa se prevé que sea en el átomo de hidrógeno, lo que implica que este compuesto no debe ser referido como hidruro astato. En este contexto, es pertinente señalar que la electronegatividad del astato en el Escala Allred-Rochow (1.9) es menor que el de hidrógeno (2,2).
Compuestos
El astato es el menos reactivo de los halógenos, siendo menos reactivo que el yodo; Sin embargo, varios compuestos de astato se han sintetizado en cantidades microscópicas y estudiado tan intensamente como sea posible antes de su desintegración radiactiva inevitable. Las reacciones implicadas son normalmente probados con soluciones diluidas de astato mezclada con grandes cantidades de yodo. El yodo actúa como un portador, asegurándose de que hay material suficiente para las técnicas de laboratorio (tales como filtración y precipitación) a trabajar.

La formación de un compuesto astatine con hidrógeno - generalmente referido como astatide hidrógeno - fue señalada por los pioneros de la química astato. Como se mencionó anteriormente, existen motivos para referirse a este compuesto como hidruro astatine lugar - astato se oxida fácilmente, por la acidificación (diluida) ácido nítrico da la A 0 o A + formas, y la adición de plata (I), entonces precipitados astato, sólo parcialmente como la plata (I) astatide (Agat) (o en absoluto). Yodo, en cambio, no se oxida, y precipita fácilmente como de plata (I) yoduro.
Sólo unos pocos astatides de metal han sido reportados, incluyendo las de sodio, paladio, plata y plomo. Algunas propiedades características de astatide plata, y los astatides alcalinos y alcalinotérreos conocidos e hipotéticos, se han estimado por extrapolación de otra plata o haluros alcalinos o alcalinos.

El astato se sabe que reaccionan con sus homólogos más ligeros yodo, bromo y cloro en estado de vapor; estas reacciones producen diatómico compuestos interhalogenados con fórmulas ATI, AtBr y ATCL. Los dos primeros compuestos también se pueden producir en el agua - astato reacciona con yodo / solución de yoduro para formar ATI, mientras AtBr requiere (aparte de astato) una de yodo / yodo monobromuro / solución de bromuro. El exceso de yoduros o bromuros puede conducir a AtBr -
2 y ATI -
2 iones, o en una solución de cloruro, que pueden producir especies como ATCL -
2 o AtBrCl - a través de reacciones de equilibrio balanceado con los cloruros. La oxidación del elemento con dicromato (en solución de ácido nítrico) mostró que la adición de cloruro de vuelta a la astato en una molécula probable que sea bien ATCL o AtOCl. Del mismo modo, AtOCl -
2 o ATCL -
2 pueden ser producidos. En una fuente de iones de plasma espectrómetro de masas , los iones similares [ATI] +, [AtBr] +, y [ATCL] + se han formado mediante la introducción de vapores de halógeno más ligeros en un helio , repleto de células que contiene astato, apoyando la existencia de moléculas neutras estables en el estado de iones de plasma. No hay fluoruros astato se han descubierto todavía. Su ausencia se ha especulativamente atribuido a la extrema reactividad de tales compuestos, incluyendo la reacción de un fluoruro inicialmente formado con las paredes del recipiente de vidrio para formar un producto no volátil. Por lo tanto, aunque la síntesis de un fluoruro de astato se piensa que es posible, puede requerir un disolvente fluoruro de halógeno líquido, como ya se ha utilizado para la caracterización de los fluoruros de radón.
Con oxígeno, no hay evidencia de la existencia de la especie AtO -, ATO -
2 y AtO + en solución acuosa, formada por la reacción de astato con un oxidante tal como bromo elemental o (en el último caso) por persulfato de sodio en una solución de ácido perclórico. El bien caracterizado AtO -
3 anión puede obtenerse a través de, por ejemplo, la oxidación de astato con hipoclorito de potasio en una solución de hidróxido de potasio. La oxidación adicional, tal como por difluoruro de xenón (en una solución alcalina caliente) o peryodato (en una solución neutra o alcalina), se obtiene el AtO ion perastatate -
4; Sin embargo, esto sólo es estable en soluciones neutras o alcalinas. El astato también se piensa que es capaz de formar sales catiónicas con oxianiones tales como yodato o dicromato; esto se basa en la observación de que, en soluciones ácidas, monovalente o estados positivos intermedios de astato coprecipitar con las sales insolubles de cationes metálicos tales como la plata (I) yodato o talio (I) dicromato.
Astatine puede formar enlaces a la otra calcógenos; estos incluyen S 7 A + y A (CSN) -
2 con azufre , una coordinación compuesto selenourea con selenio , y un astatine- telurio coloide con teluro. Además, astato se sabe que se une a nitrógeno , plomo , y de boro en las condiciones adecuadas.
Tetraastatide Carbono (CAT 4) es conocida. Astatine puede sustituir un átomo de hidrógeno en benceno para formar C 6 H 5 A; este puede estar oxidado a C 6 H 5 ATCL 2 por el cloro. Por tratamiento de este compuesto con una solución alcalina de hipoclorito, C 6 H 5 AtO 2 puede ser producido.
Historia

En 1869, cuando Dmitri Mendeleev publicara su tabla periódica , el espacio debajo de yodo estaba vacía; después Niels Bohr estableció la base física de la clasificación de los elementos químicos, se sugirió que el quinto halógeno pertenecía allí. Antes de su descubrimiento reconocido oficialmente, que se llamaba "eka-yodo" (del sánscrito eka - "uno") dar a entender que era un espacio debajo de yodo (de la misma manera como eka-silicio, eka-boro, y otros). Los científicos trataron de encontrar en la naturaleza; dada su rareza, estos intentos resultaron en un número de falsos descubrimientos.
El primer descubrimiento reclamado de eka-yodo fue hecha por Fred Allison y sus colaboradores en el Instituto Politécnico de Alabama (ahora Auburn University) en 1931. Los descubridores nombrado elemento 85 "alabamine", y le asignó el símbolo Ab, denominaciones que fueron utilizados por algunos años después. En 1934, sin embargo, HG MacPherson de Universidad de California, Berkeley refutada método de Allison y la validez de su descubrimiento. Este descubrimiento errónea fue seguida por otra demanda en 1937, por el químico Rajendralal De. Trabajar en Dhaka , India británica (ahora Bangladesh ), eligió el nombre "dakin" para el elemento 85, que afirmó haber aislado como el equivalente serie torio de Radium F (polonio-210) en el serie radio. Las propiedades que se presenten para el Dakin no se corresponden con los de astato, y la verdadera identidad de Dakin no se conoce.

En 1940, el químico suizo Walter Minder anunció el descubrimiento del elemento 85 como el producto de la desintegración beta de Radium A (polonio-218), la elección del nombre "helvetium" (de Helvetia, "Suiza"). Sin embargo, Berta Karlik y Traude Bernert no tuvieron éxito en la reproducción de sus experimentos, y posteriormente se atribuyeron los resultados de Minder a la contaminación de su flujo de radón (radón-222 es el isótopo padre de polonio-218). En 1942, Minder, en colaboración con el científico Inglés Alicia Leigh-Smith, anunció el descubrimiento de otro isótopo del elemento 85, que se presume ser el producto de torio A (polonio-216) desintegración beta. Llamaron a esta sustancia "anglo-helvetium", pero Karlik y Bernert eran de nuevo incapaz de reproducir estos resultados.
En 1940, Dale R. Corson, Kenneth Ross MacKenzie, y Emilio Segrè finalmente aisló el elemento en la Universidad de California, Berkeley. En lugar de buscar el elemento en la naturaleza, los científicos crearon bombardeando bismuto-209 con partículas alfa. El nombre "astatine" viene del griego palabra αστατος (astatos, que significa "inestable"), debido a su propensión a la la desintegración radiactiva (más tarde, todos los isótopos del elemento se mostró a ser inestable), junto con el "ine" final, que se encuentra en los nombres de los cuatro halógenos descubiertos previamente. Tres años más tarde, astato fue encontrado como un producto de origen natural cadenas de desintegración por Karlik y Bernert. Desde entonces, astato se ha determinado que en tres de las cuatro cadenas de desintegración naturales.
Isótopos
Hay 32 isótopos conocidos de astato, con masas atómicas (números de masa) de 191 y 193-223. No isótopo astatine estable o incluso de larga vida se sabe, y no se espera tal isótopo existir.
Características Alpha Decay para isótopos muestra astatine Masa
númeroMasa
excesoMasa
el exceso de
hijaPromedio
la energía de
alfa
decaimientoMedia vida Probabilidad
de alfa
decaimientoAlfa
media vida207 -13.243 MeV -19.116 MeV 5.873 MeV 1.80 h 8,6% 20.9 h 208 -12.491 MeV -18.243 MeV 5.752 MeV 1.63 h 0,55% 12.3 d 209 -12.880 MeV -18.638 MeV 5.758 MeV 5.41 h 4,1% 5.5 d 210 -11.972 MeV -17.604 MeV 5.632 MeV 8.1 h 0,175% 193 d 211 -11.647 MeV -17.630 MeV 5.983 MeV 7.21 h 41,8% 17.2 h 212 -8.621 MeV -16.436 MeV 7.825 MeV 0.31 s ≈100% 0.31 s 213 -6.579 MeV -15.834 MeV 9.255 MeV 125 ns 100% 125 ns 214 -3.380 MeV -12.366 MeV 8.986 MeV 558 ns 100% 558 ns 219 10,397 MeV 4.073 MeV 6.324 MeV 56 s 97% 58 s 220 14,350 MeV 8.298 MeV 6.052 MeV 3.71 min 8% 46,4 min 221 16,810 MeV 11,244 MeV 5.566 MeV 2.3 min experimentalmente
alfa estable∞
Astatine tiene 23 isómeros nucleares, que son núcleos con uno o más nucleones ( protones o neutrones ) en un estado excitado. Un isómero nuclear también puede ser llamado un " meta-estado ", que significa que el sistema tiene más energía interna que el " estado fundamental "(el estado con la posible energía interna más bajo), haciendo que el ex probable que decaiga en el último. Puede haber más de un isómero para cada isótopo. El más estable de estos isómeros nucleares es astato-202m1, que tiene una la vida media de unos 3 minutos, ya que los de todos los estados en tierra, excluidos los de isótopos 203-211 y 220. El menos estable es el astato-214m1; su vida media de 265 nanosegundos es más corto que los de todos los estados fundamentales, excepto la de astato-213.
Astatine de alfa energías de desintegración siguen la misma tendencia que para otros elementos pesados. Más claro isótopos astatine tienen muy altas energías de desintegración alfa, que se vuelven más bajos que los núcleos se vuelven más pesados. El astato-211, sin embargo, tiene una energía significativamente mayor que el isótopo anterior, debido a que tiene un núcleo con neutrones 126, y 126 es una número mágico que corresponde a una capa de neutrones lleno. A pesar de tener una vida media similar a la de isótopos anterior (8,1 horas para astato-210 y 7,2 horas para astato-211), el decaimiento alfa probabilidad es mucho mayor para este último: 41,81%, frente a sólo 0,18%. Los dos siguientes isótopos liberan aún más energía, con astato-213 liberar la mayor cantidad de energía de todos los isótopos de astato. Por esta razón, es el isótopo más corto astato-vivido. A pesar de que más pesados isótopos astatine liberan menos energía, existe vivido largo sin isótopo astatino, debido al creciente papel de decaimiento beta (emisión de electrones). Este modo de decaimiento es especialmente importante para astatine; ya en 1950 se postuló que el elemento no tiene isótopos beta estable (es decir, que no lo hacen desintegración beta en absoluto). Modos de desintegración beta se han encontrado para todos los isótopos astatine excepto astato-213, astato-214, astato-215, y astato-216m. Beta exhibición astato-210 e isótopos más ligeros, más caries ( por emisión de positrones), beta astato-216 e isótopos más pesados de exposiciones (menos) la decadencia, y astato-212 decae a través de ambos modos, mientras astato-211 sufre captura de electrones en lugar.
El isótopo más estable es el astato-210, que tiene una vida media de 8,1 horas. Modo de desintegración principal de este isótopo es beta plus decadencia a la relativamente larga vida (en comparación con isótopos astatine) emisor alfa polonio-210. En total, sólo cinco isótopos tienen vidas medias superiores a una hora (aquellos con números de masa entre 207 y 211). El menos estable isótopo estado fundamental es astato-213, con una vida media de 125 nanosegundos. Se alfa decae a la extremadamente larga vida (en la práctica, estable) de bismuto-209.
Presencia natural
El astato es el elemento más raro de origen natural que no es una elemento transuránicos, con la cantidad total en la corteza terrestre se estima que menos de 28 gramos (1 onza) en un momento dado. Cualquier astatine que estuvo presente en la formación de la Tierra desde hace mucho tiempo ha decaído, y las cantidades de astato existente en la actualidad se han formado a través de la desintegración de elementos más pesados. Aunque se pensaba previamente a ser el elemento más rara que ocurre en la Tierra, astato ha perdido este estado a Berkelium , átomos de los que pueden ser producidos por reacciones de captura de neutrones y la desintegración beta en muy alta concentración de uranio depósitos que alojan.
Seis isótopos astatine producen de forma natural (astato-214 a astato-219). Debido a su corta vida media , que sólo se encuentran en trazas. No hay datos que indican que el astato se produce en las estrellas.
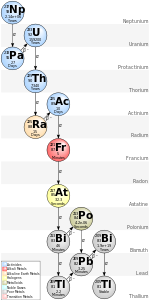
Cuatro de estos isótopos (astato-215, astato-217, astato-218, y astato-219) se encuentran debido a su producción en los principales naturales cadenas de desintegración. Francio-223, el isótopo padre de astato-219, alfa decae con una probabilidad de sólo 0,006%, haciendo de este isótopo astato extremadamente raro incluso en comparación con los otros isótopos de astato; esto es, a pesar de su vida media siendo el más largo de los isótopos de astato naturales (56 segundos). El astato-219 decae al polonio-215, que a su vez beta decae a astato-215 con una probabilidad aún menor de 0,00023%. La totalidad de Norte y Sudamérica combinado, que se considera una profundidad de 16 kilómetros (10 millas), contiene sólo alrededor de un trillón de átomos astato-215 en un momento dado. El astato-218 se encuentra en la naturaleza como resultado de polonio 218 desintegración beta; al igual que con El 223 y el polonio-215, la decadencia de un isótopo astatine no es el modo de decaimiento primario. Sin embargo, el isótopo astatino-217 tiene una cadena lineal que conduce directamente a astatine; su isótopo padre (francio-221) se descompone en exclusiva a esta nucleido. Dado que sus padres, abuelos, y así sucesivamente cada decaimiento exclusivamente a un único núclido, esto da sólo una manera posible para el nucleido a partir de la serie neptunio ( neptunio -237) a la caries - a través de la eventual producción de astato-217.
Los isótopos con números de masa 214 a través de 216 se encuentran como el resultado de la desintegración alfa de triple de la presente naturalmente protactinium isótopos protactinio-226, protactinio-227, y protactinio-228. Sin embargo, estos isótopos son extremadamente raras, tanto es así que a menudo no son citados como los isótopos astatine natural.
Síntesis
Formación
Posibles reacciones después de bombardear bismuto-209 con partículas alfa Reacción Energía de las partículas alfa 209
83 Bi + 4
2 Él → 211
85 A + 2 1
026 MeV 209
83 Bi + 4
2 Él → 210
85 Al + 3 1
040 MeV 209
83 Bi + 4
2 Él → 209
85 En 4 + 1
060 MeV
El astato fue producido por primera vez bombardeando bismuto-209 con partículas alfa energéticas, y esto es todavía la principal vía utilizada para crear la vida relativamente larga isótopos astato-209 a través de astato-211. El astato sólo se produce en cantidades microscópicas, con las técnicas modernas que permiten series de producción de 2 tera becquerelios (unos 25 microgramos ).
El isótopo más importante es el astato-211, el único que tiene actualmente un uso comercial. Para producir el objetivo de bismuto, el metal es por deposición catódica sobre un oro, cobre, o una superficie de aluminio en 50 a 100 miligramos por centímetro cuadrado. La capa de bismuto, o, alternativamente, óxido de bismuto, se fusiona a la fuerza con una placa de cobre. El objetivo se mantiene bajo un nitrógeno químicamente neutro atmósfera, y se enfría con agua para evitar la vaporización prematura astato. En un acelerador de partículas, tal como una ciclotrón, partículas alfa (núcleos de helio-4) se chocaron con el bismuto. A pesar de que sólo hay un isótopo de bismuto utilizada (de bismuto-209), la reacción puede ocurrir en tres formas posibles, produciendo astato-209, astato-210, o astato-211. A fin de eliminar los núclidos no deseados, la energía máxima de la acelerador de partículas se establece en cualquier valor (como 30 MeV) anterior que para la producción de astato-211 (para producir el isótopo deseado) de reacción y por debajo de la que produce astato-210 ( para evitar la producción de otros isótopos de astato).
Separación
Dado que el elemento es el producto principal de la síntesis, después de su formación se debe sólo ser separado de la diana y trazas de otros radioisótopos. El objetivo que contiene astato-se calienta a 270 ° C (520 ° F) para vaporizar las trazas volátiles de radioisótopos, después de lo cual se eleva la temperatura a 800 ° C (1450 ° F). Aunque el 80% de astato puede vaporizar a esta temperatura, bismuto comienza a vaporizar también. La vaporización del astato no se produce a una velocidad adecuada a temperaturas inferiores a 600 ° C (1100 ° F), pero a temperaturas superiores a 800 ° C (1450 ° F), la volatilidad del astato de un bismuto superficie aumenta significativamente. El vapor condensado ( destilado ) se recoge sobre una superficie de platino refrigerado por agua, que más tarde se trasladó a una U-como cuarzo buque. El recipiente contenedor de cuarzo se calienta a 130 ° C (270 ° F) para eliminar otras trazas de impurezas (por lo general de polonio) y luego a 500 ° C (930 ° F) para eliminar astato, que se recoge en una dedo frío. El elemento purificado se lava a continuación del dedo frío con una solución de ácido nítrico débil. Usando esta técnica, los rendimientos de astato de hasta 30% se pueden lograr.
Usos y precauciones
Varios 211 A que contienen las moléculas y sus usos Agente Aplicaciones [211] En coloides astato-telurio Tumores compartimentales 6- [211 A] difosfato astato-2-metil-1,4-naphtaquinol Los adenocarcinomas 211 azul de metileno marcado At- Los melanomas Meta- [211 A] guanidina astatobenzyl Los tumores neuroendocrinos 5- [211 A] astato-2'- desoxiuridina Vario 211 conjugados con biotina etiquetados A- Varios predireccionamiento 211 octreótido marcado At- Receptor de somatostatina 211 mAbs y fragmentos marcados At- Vario 211 bisfosfonatos marcados Al- Las metástasis óseas
El astato-211 recién formado es importante en medicina nuclear. Una vez producidos, astato debe ser utilizado de forma rápida, ya que se desintegra con una vida media de 7,2 horas; esto es, sin embargo, el tiempo suficiente para permitir estrategias de etiquetado de varios pasos. El astato-211 se puede utilizar para la radioterapia dirigida de partículas alfa, ya que se descompone ya sea a través de la emisión de una partícula alfa (al bismuto-207), o por medio de captura de electrones (a un nucleido vida extremadamente corta de polonio-211, que a su vez sufre más la desintegración alfa).
De una manera similar al yodo, astato es preferentemente concentrada en el glándula tiroides, aunque en menor medida. Sin embargo, tiende a concentrarse en el hígado en forma de un radiocoloide si se libera a la circulación sistémica. La diferencia principal entre medicinal astato-211 y yodo-131 (un isótopo de yodo radiactivo también se utiliza en la medicina) es que astato no emite partículas beta de alta energía (electrones), como lo hace el yodo-131. Las partículas beta tienen mucho mayor poder de penetración a través de los tejidos que lo hacen las partículas alfa mucho más pesadas. Mientras que una partícula promedio de energía alfa liberado por la descomposición de astato-211 puede viajar hasta 70 micras a través de los tejidos circundantes, una partícula promedio beta energía emitida por el yodo-131 puede viajar casi 30 veces más lejos, a unos 2 mm. Por lo tanto, el uso de astato-211 en lugar de yodo-131 permite la tiroides a dosificar adecuadamente, mientras que la vecina glándula paratiroides está a salvo. La vida media corta y poder de penetración limitada de su radiación a través de los tejidos renders astato generalmente preferible al yodo-131 cuando se utiliza en el diagnóstico, así.
Experimentos en ratas y monos, sin embargo, sugieren que astatine causa mucho más daño a la glándula tiroides que hace el yodo-131, con la inyección repetitiva del nucleido resultando en necrosis y celular displasia dentro de la glándula. Estos experimentos también sugieren que el astato podría causar daños a la tiroides de cualquier organismo. Las primeras investigaciones sugiere que la inyección de cantidades letales de astato causado cambios morfológicos en el tejido mamario (aunque no en otros tejidos); Sin embargo, esta conclusión en la actualidad sigue siendo controvertido.
