
Acetileno
Fundo para as escolas Wikipédia
Arranjar uma seleção Wikipedia para as escolas no mundo em desenvolvimento sem internet foi uma iniciativa da SOS Children. Patrocinar uma criança para fazer uma diferença real.
| Acetileno | |
|---|---|
| | |
 | |
Etino | |
| Identificadores | |
| Número CAS | 74-86-2 |
| Imagens-jmol 3D | Imagem 1 |
SMILES
| |
| Propriedades | |
| Fórmula molecular | C 2 H 2 |
| Massa molar | 26,0373 g / mol |
| Densidade | 1,09670 kg / m³ de gás |
| Ponto de fusão | -84 ° C (189 K, subi) |
| Acidez (p Ka) | 25 |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
Acetileno ( sistemática nome: etino), C 2 H 2, é um hidrocarboneto pertencente ao grupo de alcinos. Ele é considerado o mais simples de todos os alcinos, uma vez que é composto por duas hidrogénio átomos e dois de carbono átomos. O acetileno é um insaturado composto orgânico por causa dos seus dois átomos de carbono são triplamente ligado.
A ligação tripla carbono-carbono deixa os átomos de carbono com dois orbitais sp híbridos para sigma ligação, colocando todos os quatro átomos na mesma linha reta, com ângulos de ligação CCH de 180 °.
Acetileno foi descoberto em 1836 por Edmund Davy, que identificou-o como um "novo carburar de hidrogênio." Foi redescoberto em 1860 pelo químico francês Marcellin Berthelot, que cunhou o nome "acetileno". O ganhador do Prêmio Nobel Gustaf Dalén foi cegado por uma explosão de acetileno.
Preparação
As principais matérias-primas para fabricação de acetileno são carbonato de cálcio ( calcário) e carvão . O carbonato de cálcio é primeiro convertido em óxido de cálcio e o carvão em coque, em seguida, os dois são feitos reagir uns com os outros para formar carboneto de cálcio e do monóxido de carbono :
- CaO + 3C → CaC 2 + CO
Cálcio carboneto (ou acetileto de cálcio) e água são então feitos reagir por qualquer dos vários métodos para produzir acetileno e hidróxido de cálcio. Esta reacção foi descoberto pela Friedrich Wohler em 1862.
- CaC 2 + 2H 2 O → Ca (OH) 2 + C 2 H 2
O carboneto de cálcio síntese requer uma temperatura extremamente alta, ~ 2000 graus Celsius, de modo que a reacção é realizada numa forno elétrico a arco. Esta reação foi uma parte importante da revolução final de 1800 em química habilitado pela maciça projeto de energia hidrelétrica em Niagara Falls .
O acetileno pode ser também fabricado pela parcial combustão do metano com oxigénio , ou pela de craqueamento hidrocarbonetos.
Berthelot foi capaz de preparar de acetileno a partir de álcool metílico , álcool etílico , etileno , ou éter , quando passou por qualquer um destes na forma de gás ou vapor através de um tubo em brasa. Berthelot também encontraram acetileno foi formada por faíscas de eletricidade através misturado cianog�io e hidrogênio gases. Ele também foi capaz de formar acetileno diretamente através da combinação de hidrogênio puro com carbono usando descarga elétrica de um arco de carbono.
Reações
- Acima de 400 ° C (673 K) a pirólise de acetileno será iniciado, o qual é relativamente baixa durante um hidrocarboneto. Os principais produtos são o dímero vinylacetylene (C 4 H 4) e benzeno . A temperaturas acima de 900 ° C (1173 K), o produto principal será fuligem.
- Usando acetileno, Berthelot foi a primeira a mostrar que uma composto alifático podem formar uma composto aromático quando aquecida acetileno num tubo de vidro para a produção de benzeno com um pouco de tolueno . Berthelot acetileno oxidado para se obter o ácido acético e ácido oxálico. Encontrou acetileno pode ser reduzido para formar etileno e etano .
- Polimerização de acetileno com Os catalisadores de Ziegler-Natta produz filmes poliacetileno. Poliacetileno, uma cadeia de moléculas de carbono com a alternância de ligações simples e duplas, foi o primeiro semicondutor orgânico a ser descoberto; reacção com iodo produz um material extremamente condutora.
- Na reacção Kucherov (inventado em 1881 pelo químico russo Mikhail Kucherov) acetileno é hidratado de acetaldeído com uma mercúrio sal, tal como brometo de mercúrio (II). Antes do advento do processo Wacker esta reacção foi realizada a uma escala industrial.
Reppe química
Walter Reppe descoberto que acetileno pode reagir a altas pressões de metais pesados catalisadores para dar produtos químicos industrialmente significativos:
- Acetileno reagir com álcoois , cianeto de hidrogénio , cloreto de hidrogénio, ou ácidos carboxílicos para dar compostos vinílicos:

- Com aldeídos para se obter dióis etinilo.
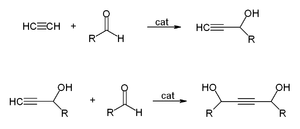
Isto é usado para produzir industrialmente 1,4-butynediol de formaldeído e acetileno:
- HCCH + CH2O → CH 2 (OH) 2 OH CCCH
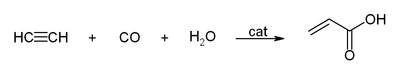
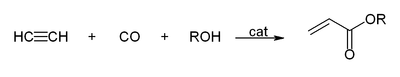
- Com o monóxido de carbono para dar ácido acrílico, ou ésteres acrílicos, que pode ser usado para produzir vidro acrílico.
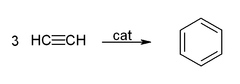
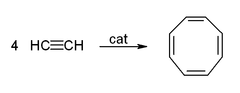
- Cyclicization para dar benzeno e ciclooctatetraeno:
Usos
Aproximadamente 80 por cento do acetileno produzidas anualmente no Estados Unidos é utilizado em síntese química. A 20 por cento restantes é utilizado principalmente para oxyacetylene soldadura de gás e de corte, devido à alta temperatura da chama; combustão do acetileno com o oxigénio produz uma chama de mais de 3300 ° C (6000 ° F), libertando 11,8 kJ / g. Oxyacetylene é o mais quente de gás de queima de combustível comum. Cyanogen, um gás mais exótico, produz uma chama de mais de 4525 ° C (8180 ° F) quando se queima em oxigênio.
O acetileno é também utilizado no acetileno ("carboneto ') da lâmpada, uma vez utilizado por mineiros (para não ser confundido com o Davy lâmpada), no vintage carros , e ainda por vezes utilizado por espeleólogos. Neste contexto, o acetileno é gerado por gotejamento de água a partir da câmara superior para a lâmpada carboneto de cálcio (CAC 2) pelotas na base da lâmpada.
Em outros tempos algumas cidades uso de acetileno para iluminação, incluindo Tata na Hungria , onde foi instalado no 24 julho 1897 , e North Petherton, Inglaterra , em 1898.
Nos tempos modernos, o acetileno é usado às vezes para carburação (isto é, endurecimento) do aço quando o objecto for demasiado grande para caber dentro de um forno.
O acetileno foi proposta como uma matéria-prima de carbono para fabricação molecular utilizando nanotecnologia. Uma vez que não ocorrem naturalmente, usando acetileno poderia limitar out-of-control auto-replicação.
O acetileno é utilizado para volatilizar carbono em datação por radiocarbono. O material carbonoso na amostra arqueológica reagir num pequeno forno de pesquisa especializados, com lítio metálico para formar carboneto de lítio (também conhecido como acetileto de lítio). O carboneto pode então ser feito reagir com a água, como de costume, para formar gás de acetileno, a integrar no espectrômetro de massa para resolver a razão isotópica de carbono 14 para carbono 12.
O Futuro
É esperado que o uso de acetileno para continuar um aumento gradual no futuro à medida que novas aplicações são desenvolvidas. Uma nova aplicação é a conversão do acetileno a etileno para utilização na preparação de uma variedade de plásticos de polietileno. No passado, uma pequena quantidade de acetileno tinha sido gerada e desperdiçado como parte do processo de cracking a vapor usado para fazer etileno. Um novo catalisador desenvolvido por Phillips Petroleum permite que a maior parte deste acetileno para ser convertido em etileno por rendimentos aumentados a um custo global reduzido.
Segurança e manuseio
Compressão
Devido à ligação tripla carbono-carbono, gás acetileno é fundamentalmente instável, e vontade decompor numa exotérmica reação se comprimida em grande extensão. O acetileno pode explodir com violência extrema, se a pressão do gás excede cerca de 100 kPa (≈14.5 psi) na forma de um gás ou, quando sob a forma líquida ou sólida, por isso, é transportado e armazenado dissolvido em acetona ou dimetilformamida (DMF), contido num cilindro de metal com recheio poroso ( Agamassan), que torna seguro de transportar e usar.
Existem normas rigorosas sobre o envio de perigosa cilindros de gás em todo o mundo. O uso de acetileno dissolvido está diminuindo rapidamente, graças às favoráveis sem chama de soldagem processos.
Os efeitos tóxicos
Inalar acetileno pode causar tonturas, dores de cabeça e náuseas. Pode também conter impurezas tóxicas: o Associação de Gás Comprimido Especificação Commodity para acetileno estabeleceu um sistema de classificação para a identificação e quantificação fosfina, arsina, e teor em sulfureto de hidrogénio em graus comerciais de acetileno, a fim de limitar a exposição a estas impurezas. O enxofre, fósforo e de arsénio são transições da síntese ingrediente de coque, uma forma impura de carbono e diferentes impurezas orgânicas, seria de esperar a partir do craqueamento térmico de hidrocarbonetos de origem.
Enquanto as impurezas de acetileno podem ser tóxicos e até fatais, acetileno puro é de uma toxicidade muito baixa (sem contar com os efeitos narcóticos ""). Até 80% por cento, (v / v) de acetileno foi administrado a pacientes de cirurgia com anestesia geral. O nome comercial para o acetileno era "narcylene." Foi usada uma quantidade justa experimentalmente na Alemanha em suas empobrecidas 1920, talvez em vários milhares de pacientes. Clinicamente, acetileno foi considerado ser tão seguro quanto óxido nitroso e com uma potência ligeiramente mais elevado, permitindo a utilização de maiores percentagens de oxigénio na mistura; é cerca de 50% mais potente. No entanto, a utilização de misturas de acetileno e oxigénio foi abandonada depois de várias explosões de gases no interior dos pulmões do paciente. A energia dessas explosões seria de esperar que ultrapassem os anestésicos inalatórios inflamáveis devido à instabilidade da ligação tripla (cyclopropane seria tão ruim). Sugeriu-se que uma tal explosão tórax interno não pode ocorrer com misturas de ar sem oxigénio (purificada).
Acetileno foi abusada raramente de forma semelhante ao abuso de óxido nitroso-se através de tempos modernos, de acordo com a literatura. Tal abuso podem resultar na morte do abusador devido à toxicidade das impurezas acima mencionadas fosfina, arsina, e sulfeto de hidrogênio. Uma vez que o gás é carregada (absorvido) embebidos em tanques com acetona através de uma matriz sólida, um pouco de acetona sai com o gás, contribuindo ainda mais para os envenenamentos. O driver para este comportamento abusivo é melhor compreendido com a visão de propriedades anestésicas de acetileno e comportamentos de dependência.
Impurezas em acetileno são facilmente detectáveis pelo olfato. Acetileno puro é um gás incolor e inodoro. A característica alho odor -como de acetileno grau técnico é atribuível a contaminação por impurezas. As impurezas que podem estar presentes incluem: sulfureto de divinilo, amônia , oxigênio , nitrogênio , fosfina, arsina, metano , dióxido de carbono , monóxido de carbono , sulfeto de hidrogênio, acetileno de vinilo, acetileno divinil, diacetileno, propadieno, hexadieno, butadienil acetileno, e metil acetileno.
O risco de incêndio
Misturas com o ar contendo entre 3% e 82% de acetileno são explosivas em ignição. A temperatura mínima de ignição é 335 ° C. A maior parte da energia química de acetileno é o que não está contido em que a ligação tripla carbono-carbono; isto é, é maior do que a de três ligações de carbono-carbono se espalham, mas daí não é permitido devido aos espaços entre o seu companheiro de carbono e todos os outros carbonos da mesma forma blindados em carga.
Incompatibilidades
Outros significados
Às vezes, os "acetilenos" plural pode referir-se a classe de compostos químicos orgânicos conhecidos como alcinos que contêm o grupo -C = C-.
Ocorrência natural
O acetileno é um produto químico moderadamente comum no universo, muitas vezes associada com as atmosferas de planetas gasosos . Uma descoberta de acetileno é curioso sobre Enceladus, uma lua de Saturno . Acredita-se que o acetileno natural para formar a partir de qualquer catalítica decomposição de hidrocarbonetos de cadeia longa ou a temperaturas ≥ 1.770 kelvin . Uma vez que tais temperaturas são altamente improvável em um corpo tão pequeno distante, esta descoberta é potencialmente sugestiva de reações catalíticas dentro da lua, tornando-se um local promissor para procurar química prebiótica.
