
Azoto
Fundo para as escolas Wikipédia
Arranjar uma seleção Wikipedia para as escolas no mundo em desenvolvimento sem internet foi uma iniciativa da SOS Children. Uma boa maneira de ajudar outras crianças é por patrocinar uma criança
| Azoto | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
7 N | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||
gás incolor, líquido ou sólido  Nitrogênio líquido Linhas espectrais de azoto | |||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||
| Nome, símbolo, número | de azoto, N, 7 | ||||||||||||||||||||||||
| Pronúncia | / n aɪ t r ə dʒ ə n / NY -trə-jən | ||||||||||||||||||||||||
| Categoria elemento | metalóide | ||||||||||||||||||||||||
| Grupo, período, bloco | 15 (pnictogens), 2, p | ||||||||||||||||||||||||
| Peso atômico padrão | 14,007 (1) | ||||||||||||||||||||||||
| Configuração eletrônica | [Ele] 2s 2p 2 3 2, 5 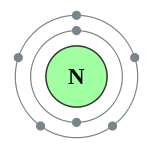 | ||||||||||||||||||||||||
| História | |||||||||||||||||||||||||
| Descoberta | Daniel Rutherford (1772) | ||||||||||||||||||||||||
| Nomeado por | Jean-Antoine Chaptal (1790) | ||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||
| Fase | gás | ||||||||||||||||||||||||
| Densidade | (0 ° C, 101,325 kPa) 1,251 g / L | ||||||||||||||||||||||||
| Líquido densidade no pb | 0,808 g · cm -3 | ||||||||||||||||||||||||
| Ponto de fusão | 63,15 K , -210,00 ° C, -346,00 ° F | ||||||||||||||||||||||||
| Ponto de ebulição | 77.36 K, -195,79 ° C, -320,33 ° F | ||||||||||||||||||||||||
| Ponto Triplo | 63,1526 K (-210 ° C), 12,53 kPa | ||||||||||||||||||||||||
| Ponto crítico | 126,19 K, 3,3978 MPa | ||||||||||||||||||||||||
| Calor de fusão | (N2) 0,72 kJ mol -1 · | ||||||||||||||||||||||||
| Calor de vaporização | (N2) 5,56 kJ mol -1 · | ||||||||||||||||||||||||
| Capacidade calorífica molar | (N 2) 29,124 J · · mol -1 K -1 | ||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||
| Estados de oxidação | 5, 4, 3, 2, 1, -1, -2, -3 (Fortemente ácida óxido) | ||||||||||||||||||||||||
| Eletronegatividade | 3,04 (escala de Pauling) | ||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 1402,3 kJ · mol -1 | ||||||||||||||||||||||||
| 2: 2856 kJ · mol -1 | |||||||||||||||||||||||||
| 3: 4578,1 kJ · mol -1 | |||||||||||||||||||||||||
| O raio de covalência | 71 ± 13:00 | ||||||||||||||||||||||||
| Van der Waals raio | 155 pm | ||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||
| A estrutura de cristal | hexagonal  | ||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | ||||||||||||||||||||||||
| Condutividade térmica | 25,83 × 10 -3 W · m -1 · K -1 | ||||||||||||||||||||||||
| Velocidade do som | (Gás, 27 ° C) 353 m · s -1 | ||||||||||||||||||||||||
| Número de registo CAS | 7727-37-9 | ||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||
| Ver artigo principal: Os isótopos de azoto | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
O nitrogênio é um elemento químico com o símbolo N e número atômico 7. Elemental nitrogênio é um gás incolor, inodoro, insípido e, principalmente, inerte gás diatômico na condições normais, constituindo 78,09% em volume de atmosfera da Terra . O nitrogênio elemento foi descoberto como um componente separável do ar, pelo médico escocês Daniel Rutherford, em 1772. Pertence à família grupo do nitrogênio.
O nitrogênio é um elemento comum no universo, estimada em cerca de sétimo em abundância total em nossa galáxia e do Sistema Solar . É sintetizada por fusão de carbono e hidrogénio em supernovas . Devido à volatilidade de nitrogênio elementar e seus compostos comuns com hidrogênio e oxigênio, o nitrogênio é muito menos comum nos planetas rochosos do Sistema Solar interior, e é um elemento relativamente raro na Terra como um todo. No entanto, como na Terra, nitrogênio e seus compostos ocorrem comumente como gases na atmosfera de planetas e luas que têm atmosferas.
Muitos compostos industrialmente importantes, tais como amónia , ácido nítrico , nitratos orgânicos ( propulsores e explosivos), e cianetos, contêm azoto. O extremamente forte vínculo em nitrogênio elementar domina a química de nitrogênio, causando dificuldade para ambos os organismos e indústria na conversão (ou "fixação") do N 2 em úteis compostos , mas, ao mesmo tempo causando a liberação de grandes quantidades de energia muitas vezes útil quando os compostos queimar, explodir, ou decair de volta em gás nitrogênio. Sinteticamente produzido amoníaco e nitratos são industriais chaves fertilizantes e nitratos de fertilizantes são a chave poluentes em causar a eutrofização dos sistemas de água.
Fora dos seus principais usos como fertilizantes e-lojas de energia, compostos de nitrogênio são orgânicos versáteis. O nitrogênio é parte de materiais tão diversos como Kevlar tecido e cianoacrilato cola "super". O nitrogênio é um componente de moléculas em cada grande classe de droga farmacológica, incluindo os antibióticos . Muitas drogas são imita ou pró-fármacos de moléculas de sinal contendo azoto naturais: por exemplo, os nitratos orgânicos e nitroglicerina nitroprusside controle da pressão arterial por ser metabolizado a catástrofes naturais óxido nítrico. Planta alcalóides (frequentemente produtos químicos de defesa) contêm nitrogênio, por definição e, portanto, muitos medicamentos que contêm nitrogênio notáveis, tais como cafeína e morfina ou são alcalóides ou imita sintéticos que funcionam (como muitos alcalóides de plantas fazer) sobre os receptores de animais neurotransmissores (por exemplo, sintéticas anfetaminas).
Azoto ocorre em todos os organismos, principalmente em ácidos aminados (e, assim, proteínas ) e também nas ácidos nucleicos ( ADN e ARN). O corpo humano contém cerca de 3% em peso de azoto, o quarto elemento mais abundante no corpo depois de oxigénio, carbono e hidrogénio. O ciclo do nitrogênio descreve o movimento do elemento do ar para os biosfera compostos orgânicos e, em seguida, volta para a atmosfera.
História e etimologia
O nitrogênio é formalmente considerado para ter sido descoberto pelo médico escocês Daniel Rutherford em 1772, que o chamou de ar nocivo ou ar fixo. O facto de que havia constituinte do ar que não suporta combustão ficou claro para Rutherford. Azoto foi também estudada em aproximadamente o mesmo tempo pela Carl Wilhelm Scheele, Henry Cavendish, e Joseph Priestley, que se referiu a ele como o ar ou queimado phlogisticated ar. Azoto gasoso foi inerte suficiente para que Antoine Lavoisier refere a ele como " ar mephitic "ou azote, da palavra grega ἄζωτος (azotos), que significa" sem vida ". Nele, os animais morreram e as chamas foram extintas. O nome de Lavoisier para o nitrogênio é usado em muitas línguas (francês, italiano, polonês, russo, albanês, etc. .) e ainda permanece em Inglês agora os nomes comuns de muitos compostos, tais como hidrazina e compostos de ião azida.
A palavra Inglês nitrogênio (1794) entrou na língua do nitrogène francês, cunhado em 1790 pelo químico francês Jean-Antoine Chaptal (1756-1832), a partir do "nitron" Greek ( carbonato de sódio) e o gene Francês (produção). O gás tinha sido encontrada em ácido nítrico . Significado de Chaptal foi que o gás azoto é o componente essencial de ácido nítrico, por sua vez formado a partir de nitrato de potássio ( nitrato de potássio ), seguida, conhecido como salitre. Esta palavra no mundo mais antigo descrito originalmente de sódio sais que não contêm nitrato, e é um cognato de natron.
Compostos de nitrogênio eram bem conhecidos pelos Idade Média. Os alquimistas sabiam ácido nítrico como fortis do aqua (água forte). A mistura de ácido nítrico e ácido clorídrico foi conhecido como água régia (água régia), celebrada por sua capacidade de dissolver ouro (o rei de metais). O mais antigo militar, e aplicações agrícolas industriais de compostos de nitrogênio utilizado salitre ( nitrato de sódio ou nitrato de potássio), mais notavelmente na pólvora , e, posteriormente, como fertilizante . Em 1910, Lord Rayleigh descobriram que uma descarga elétrica em gás nitrogênio produzido "nitrogênio ativo", uma allotrope considerado monatomic. A "nuvem rodopiante de brilhante luz amarela", produzido por seu aparelho reage com mercúrio para produzir explosivos nitreto de mercúrio.
Produção
O nitrogênio é um gás gás industrial produzido pelo fraccionada destilação do líquido de ar , ou por meios mecânicos utilizando ar gasoso (isto é, pressurizada reversa membrana de osmose ou Pressure Swing adsorção). Comercial azoto é frequentemente um subproduto de-ar para processamento industrial da concentração de oxigénio para a produção de aço e outros fins. Quando fornecido comprimido em cilindros é chamado frequentemente OFN (nitrogênio livre de oxigênio).
Em um laboratório químico que é preparado por tratamento de uma solução aquosa de com cloreto de amónio de nitrito de sódio.
- NH 4 Cl (aq) + NaNO2 (aq) → N 2 (g) + NaCl (aq) + 2H 2 O (l)
Pequenas quantidades de impurezas NO e HNO3 são também formados nesta reacção. As impurezas podem ser removidas fazendo passar o gás através do ácido sulfúrico aquoso contendo dicromato de potássio. Muito azoto puro, podem ser preparados por decomposição térmica de bário ou azida de azida de sódio.
- 2 NaN3 → 2 Na + 3 N 2
Propriedades
O nitrogênio é um metalóide, com um eletronegatividade de 3,04. Ele tem cinco elétrons em sua escudo exterior e, portanto, é trivalente na maioria dos compostos. O ligação tripla em azoto molecular (N2) é um dos mais fortes. A dificuldade resultante da conversão de N 2 em outros compostos, ea facilidade (e liberação de alta energia associada) de conversão de compostos de azoto em N elementar 2, têm dominado o papel do nitrogênio na natureza e actividades económicas humanas.
Em azoto molecular pressão atmosférica condensa ( liquefaz ) a 77 K (-195,79 ° C ) e congela a 63 K (-210,01 ° C) para o beta hexagonal cheio de cristal fim allotropic formulário. Abaixo 35.4 K (-237,6 ° C) de azoto assume a cristalina cúbica forma alotrópica (chamada a fase alfa). O nitrogénio líquido, um fluido de água que se assemelha em aparência, mas com 80,8% da densidade (densidade de azoto líquido no seu ponto de ebulição é de 0,808 g / ml), é um comum cryogen.
Allotropes instáveis de azoto que consiste em mais do que dois átomos de azoto tenham sido produzidos em laboratório, como N e 3 N 4. Sob pressões extremamente altas (1,1 milhões atm) e altas temperaturas (2000 K), tal como produzido usando um bigorna de diamante, nitrogênio polimeriza na estrutura de cristal cúbica gauche single-ligado. Esta estrutura é semelhante à do diamante , e ambos têm extremamente forte ligações covalentes. N 4 é apelidado de "diamantes de azoto".
Outros ainda (como unsynthesized) allotropes incluem hexazine (6 N, um benzeno analógico) e octaazacubane (N 8, uma analógico cubano). O primeiro é previsto para ser altamente instável, enquanto que o último está previsto para ser cineticamente estável, por razões de simetria orbital.
Isótopos
Existem dois estáveis isótopos de azoto: 14 N e 15 N. De longe a mais comum é de 14 N (99,634%), que é produzido na Ciclo CNO em estrelas . Dos dez isótopos produzidos sinteticamente, 13 N tem uma meia-vida de 10 minutos e os restantes isótopos têm semi-vidas da ordem de segundos ou menos.
Reacções mediada biologicamente (por exemplo, assimilação, nitrificação , e desnitrificação) controlar fortemente dinâmica do nitrogênio no solo. Estas reacções resultam tipicamente em 15 N enriquecimento do substrato e esgotamento da produto.
Uma pequena parte (0,73%) do nitrogênio molecular na atmosfera da Terra é o isotopogo 14 N 15 N, e quase todo o resto é de 14 N2.
O radioisótopo 16 N é o radionuclido dominante no refrigerante de reatores de água pressurizada ou reatores de água fervente durante a operação normal. É produzido a partir de 16 S (em água) através (N, p) reacção. Tem uma curta meia-vida de cerca de 7,1 s, mas durante o seu decaimento de volta para 16O produz alta energia radiação gama (5 a 7 MeV).
Devido a isso, o acesso à tubagem refrigerante primário num reactor de água à pressão deve ser restringido durante a operação de alimentação do reactor. 16 N é um dos principais meios usados para detectar imediatamente, mesmo pequenas fugas de fluido de arrefecimento primário para o ciclo de vapor secundário.
De forma semelhante, o acesso a qualquer um dos componentes de ciclo a vapor em um reator de água fervente usina nuclear deve ser restringido durante a operação. O condensado do condensador é normalmente mantida durante 10 minutos para permitir a decomposição do 16 N. Isso elimina a necessidade de proteger e restringir o acesso a qualquer uma das tubulações de água de alimentação ou bombas.
Espectro eletromagnético

Azoto molecular (N2 14) é largamente transparente para e infravermelho radiação visível, porque é um homonuclear molécula e, portanto, não tem nenhuma momento de dipolo para casal a radiação eletromagnética para estes comprimentos de onda. Significativo absorção ocorre no extremo ultravioleta comprimentos de onda, começando cerca de 100 nanômetros. Isto está associado com transições eletrônicas na molécula para os estados em que taxa não é distribuído uniformemente entre os átomos de nitrogênio. Absorção de nitrogênio leva a absorção significativa de radiação ultravioleta na atmosfera superior da Terra e as atmosferas de outros corpos planetários. Por razões semelhantes, puro molecular lasers de nitrogênio normalmente emite luz na faixa do ultravioleta.
O nitrogênio também faz uma contribuição para visível ar fulgor da atmosfera superior da Terra, através da excitação impacto de electrões seguido por emissão. Esse brilho ar azul visível (visto no polar Aurora e no brilho de reentrada de retornar sonda) não resulta tipicamente de entre azoto molecular, mas, em vez de átomos de azoto livres que combinam com o oxigénio para formar óxido nítrico (NO).
Gás nitrogênio também exibe cintilação.
Reações
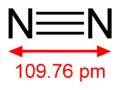
Em geral, o azoto é não reactiva à temperatura e pressão padrão. N 2 reage espontaneamente com poucos reagentes, sendo resistente a ácidos e bases, assim como a maioria dos oxidantes e redutores. Quando o nitrogênio reage espontaneamente com um reagente, a transformação líquido é muitas vezes chamado fixação de nitrogênio .
Azoto reage com elementar lítio . Queima de lítio, numa atmosfera de N2 para dar nitreto de lítio:
- 6 Li + N 2 → 2 Li 3N
O magnésio também queima em nitrogênio, formando nitreto de magnésio.
- 3 mg de N + 2 Mg → 3 N2
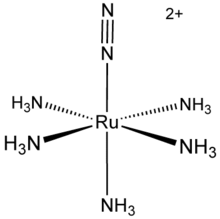
N 2 forma uma variedade de aductos com metais de transição. O primeiro exemplo de um complexo dinitrogen é [Ru (NH3) 5 (N 2)] 2+ (ver figura à direita). No entanto, é interessante observar que o ligando de N2, foi obtida a partir da decomposição da hidrazina, e não coordenação de diazoto livre. Tais compostos são já numerosas, outros exemplos incluem IrCl (N 2) (PPh3) 2, W (N 2) 2 ( Ph 2 PCH 2 CH 2 PPh 2) 2, e [(η 5 -C 5 H 4 Me) 2 Zr] 2 ( 2 μ, η 2, η 2 -N 2). Estes complexos ilustram como N2 pode ligar-se ao metal (s) em nitrogenase e o catalisador para o Processo Haber. Um processo catalítico para reduzir N 2 a amónia com o uso de um molibdénio complexo na presença de uma fonte de protões foi publicado em 2005.
O ponto de partida para a produção industrial dos compostos de azoto é o Processo de Haber, em que o azoto é fixado por reacção de N 2 e H 2 ao longo de um ferro (II, III), óxido de (Fe 3 O 4) de catalisador a cerca de 500 ° C e 200 atmosferas de pressão. Fixação biológica de nitrogênio em vida livre cianobactérias e na nódulos radiculares de plantas também produz amônia a partir de nitrogênio molecular. A reacção, que é a fonte da maior parte de azoto na biosfera , é catalisada pela nitrogenase complexo enzimático que contém átomos de Fe e Mo, utilizando a energia derivada da hidrólise da adenosina trifosfato (ATP) em difosfato de adenosina e inorgânico fosfato (-20,5 kJ / mol).
Ocorrência
O azoto é o maior constituinte da Terra 's atmosfera (78,082%, em volume, de ar seco, 75,3%, em peso, em ar seco). No entanto, esta elevada concentração não reflete baixa abundância global de nitrogênio na composição da Terra, a partir do qual a maior parte do elemento escapou por evaporação solar, no início da formação do planeta.
O nitrogênio é um elemento comum no universo, e é estimado em cerca de sétimo mais abundante elemento químico em massa no universo, a nossa galáxia eo sistema solar. A sua ocorrência não está pensado para ser inteiramente devido a síntese por fusão a partir de carbono e hidrogénio em supernovas. Nestes lugares ele foi originalmente criado por processos de fusão de carbono e hidrogênio em supernovas . Molecular nitrogênio e nitrogênio compostos foram detectados em espaço interestelar por astrônomos usando o Ultravioleta distante espectroscópica Explorer.
Devido à volatilidade do azoto elementar e também os seus compostos comuns com hidrogénio e oxigénio, de azoto e seus compostos foram expulsos do planetesimais no Sistema Solar cedo pelo calor do Sol, e sob a forma de gases, foram perdidos para os planetas rochosos do Sistema Solar interior. O azoto é um elemento, por conseguinte, relativamente rara em esses planetas interiores, incluindo a Terra, como um todo. Neste, o nitrogênio se assemelha neon, que tem uma abundância semelhante no universo, mas também é raro no Sistema Solar interior. O nitrogênio é estimado em 30 th dos elementos em abundância crustal. Existem alguns minerais de nitrogênio relativamente incomuns, como salitre (nitrato de potássio), Chile salitre (nitrato de sódio) e sal amoníaco (cloreto de amónio). Mesmo estes são conhecidos principalmente como concentrado por evaporação a partir de camas oceano, devido à sua solubilidade mais de pronto que ocorrem naturalmente compostos de azoto na água. Um padrão semelhante ocorre com a solubilidade em água do raro elemento luz boro .
No entanto, nitrogênio e seus compostos são muito mais comuns como gases na atmosfera de planetas e luas que são grandes o suficiente para ter atmosferas. Por exemplo, o nitrogênio molecular é um dos principais constituintes de não só a atmosfera da Terra, mas também a de Saturno lua Espessa atmosfera de Titã. Além disso, devido à retension por gravidade em temperaturas mais frias, nitrogênio e seus compostos ocorrem em apreciável para traçar valores em atmosferas planetárias dos planetas gigantes de gás.
Azoto está presente em todos os organismos vivos, em proteínas, ácidos nucleicos e outras moléculas. Em geral, faz-se cerca de 4% do peso seco da matéria da planta, e cerca de 3% do peso do corpo humano. É um grande componente de resíduos animais (por exemplo, guano), geralmente sob a forma de ureia , ácido úrico, compostos de amónio, e derivados destes produtos nitrogenados, que são essenciais nutrientes para todas as plantas que não podem fixar o nitrogênio atmosférico .
Compostos
A principal neutro hidreto de azoto é amoníaco (N H 3), embora hidrazina (N 2 H 4) também é utilizada. O amoníaco é mais básico de água por seis ordens de magnitude. Na solução de amoníaco a forma amónio ião (NH +
4). Amoníaco líquido (ponto de ebulição 240 K) é anfótero (exibindo ou Brønsted-Lowry carácter ácido ou básico) e forma de amônio e menos comum íons de amida (NH -
2); amidas e tanto nitreto (N 3-) sais são conhecidos, mas decompor na água. Individualmente, os compostos de alquilo duplamente, triplamente e quadruply substituídos de amoníaco são chamadas aminas (quatro substituições, para formar comercialmente e biologicamente importantes aminas quaternárias, resulta em um azoto carregado positivamente e, portanto, um solúvel em água, ou pelo menos anfifílica, composto). Cadeias maiores, anéis e estruturas de hidretos de azoto são também conhecidas, mas são geralmente instáveis.
Outras classes de nitrogênio ânions (íons carregados negativamente) são o venenoso azidas (N -
3), que são lineares e isoeletrônica para dióxido de carbono , mas que se ligam a importantes enzimas que contêm ferro no corpo de uma maneira que se assemelha mais cianeto. Outra molécula de a mesma estrutura é o gás anestésico incolor e relativamente inerte O óxido nitroso (monóxido de diazoto, N 2 O), também conhecido como gás hilariante. Este é um de uma variedade de azoto óxidos que formam uma família muitas vezes abreviado como NOX. Óxido nítrico ( monóxido de azoto, NO), é natural usados radical livre em transdução de sinal em ambas as plantas e animais, por exemplo, em vasodilatação, fazendo com que o músculo liso dos vasos sanguíneos para relaxar. O avermelhada e venenoso dióxido de azoto NO 2 contém um desemparelhado de electrões e é um componente importante de poluição atmosférica . Moléculas de nitrogênio contendo elétrons desemparelhados mostram uma tendência para dimerizam (emparelhando assim os electrões), e são, em geral, altamente reactivo. Os ácidos correspondentes são HNO 2 nitroso e ácido nítrico HNO 3, com os correspondentes sais chamados nitritos e nitratos .}
Os óxidos superiores trióxido de diazoto N 2 O 3, tetróxido N 2 O 4 e pentóxido de diazoto N 2 O 5, são instáveis e explosivos, uma consequência da estabilidade química de N 2. Quase todos os motor de foguete hypergolic usa N 2 O 4 como oxidante; seus combustíveis, várias formas de hidrazina, também são compostos de nitrogênio. Estes mecanismos são usados extensivamente na nave espacial, tais como o vaivém espacial e as do Programa Apollo porque seus propulsores são líquidos à temperatura ambiente e ignição ocorre em contato sem um sistema de ignição, permitindo que muitas queimaduras precisamente controladas. Alguns veículos de lançamento, tais como o Titan II e Ariane 1 a 4 também utilizar combustíveis hipergólicos, embora a tendência é longe de tais motores, por razões de custo e segurança. N 2 O 4 é um intermediário no fabrico de ácido nítrico HNO 3, um dos ácidos mais fortes do que alguns hydronium e um bastante forte agente oxidante.
O nitrogênio é notável para a gama de compostos explosivamente instáveis que podem produzir. Triiodide nitrogênio NI 3 é um extremamente sensível contactar explosivo. A nitrocelulose, produzido por nitração de celulose com ácido nítrico, é também conhecido como guncotton. Nitroglicerina, feita por nitração de glicerina, é o ingrediente perigosamente instável de explosivo dinamite. O explosivo relativamente estável, mas menos potente trinitrotolueno (TNT) é o explosivo padrão contra o qual o poder de explosões nucleares são medidos.
De azoto também pode ser encontrado em compostos orgânicos . Azoto comum grupos funcionais incluem: aminas , amidas, grupos nitro, iminas, e enaminas. A quantidade de nitrogênio em um substância química pode ser determinada pela Método de Kjeldahl.
Aplicações

Gás nitrogênio
Azoto gasoso tem uma variedade de aplicações, inclusive servindo como um substituição inerte para o ar onde a oxidação é indesejável;
- Como uma atmosfera modificada, puro ou misturado com dióxido de carbono , para preservar a frescura dos alimentos embalados ou a granel (por atrasar ranço e outras formas de dano oxidativo) de nitrogênio puro como aditivo alimentar é rotulado na União eurpean com o E o número E941 .
- Em comum lâmpadas incandescentes como uma alternativa barata para argônio .
- A produção de peças eletrônicas, tais como transistores, diodos, e circuitos integrados .
- E secou-se sob pressão, como um dielétrico gás para equipamento de alta tensão.
- A fabricação de aço inoxidável.
- Usado em sistemas de combustível de aeronaves militares para reduzir o risco de incêndio, (ver sistema de inertização).
- Em cima de explosivos líquidos como medida de segurança.
- Encher automóvel e aeronave pneus devido à sua inércia e falta de umidade ou qualidades oxidativas, em oposição ao ar. A diferença no teor de N entre 2 e ar puro N2 é 20%.
- Usado como um propulsor de projecto de vinho , e como uma alternativa a ou em conjunto com dióxido de carbono para outras bebidas.
O nitrogênio é comumente usado durante os procedimentos de preparação de amostras para análise química. Ela é utilizada para concentrar e reduzir o volume de amostras líquidas. Dirigir um fluxo pressurizado de gás azoto perpendicular à superfície do líquido permite que o solvente se evapore, deixando o soluto (s) e não-solvente evaporado para trás.
Tanques de nitrogênio também estão substituindo o dióxido de carbono como principal fonte de energia para armas de paintball. De azoto deve ser mantido a uma pressão mais elevada do que o CO 2, que faz N 2 tanques mais pesados e mais caros.
De azoto pode ser utilizado como um substituto ou em combinação com, o dióxido de carbono para pressurizar barris de algumas cervejas , particularmente stouts e britânicos ales, devido à menor que produz bolhas, o que faz com que a cerveja distribuída mais suave e headier. Uma cápsula de pressão de azoto sensível conhecido geralmente como um " do widget "permite azoto carregado cervejas de ser embalados em latas e garrafas.
Nitrogênio líquido
O nitrogênio líquido é um líquido criogénico. À pressão atmosférica, que entra em ebulição a -195,8 ° C. Quando isolados em recipientes adequados, tais como Frascos Dewar, que pode ser transportada sem muita perda por evaporação.
Como gelo seco , o principal uso do nitrogênio líquido é como um refrigerante. Entre outras coisas, é usado no criopreservação de sangue, células reprodutivas ( e esperma de ovo), e outras amostras biológicas e materiais. Ele é utilizado na prática clínica em crioterapia para remover os cistos e verrugas na pele. É utilizado em armadilhas frias para certos equipamentos de laboratório e para refrigerar Os detectores de infravermelhos ou Os detectores de raios-X. Também tem sido utilizado para arrefecer as unidades de processamento central e outros dispositivos que estão em computadores overclock, e que produzem mais calor do que durante a operação normal.
Compostos de azoto
Azoto molecular (N2) na atmosfera é relativamente não reactivo, devido à sua ligação forte, e N 2 desempenha um papel inerte no corpo humano, sendo produzido nem destruídas. Na natureza, o nitrogênio é convertido em biologicamente (e industrialmente) compostos úteis por um raio, e por alguns organismos vivos, nomeadamente certas bactérias (ou seja, fixação de nitrogênio bactérias ver papel Biológica abaixo). Nitrogênio molecular é liberado para a atmosfera no processo de cárie, em tecidos de plantas e animais mortos.
A capacidade de combinar, ou corrigir, nitrogênio molecular é uma característica fundamental da química industrial moderno, onde o nitrogênio e gás natural são convertidas em amônia através do Processo Haber. O amoníaco, por sua vez, pode ser usado directamente (principalmente como um fertilizante , e na síntese dos adubos nitrados), ou como um precursor de muitos outros materiais importantes incluindo explosivos, em grande parte, através da produção de ácido nítrico pelo Processo de Ostwald.
Os orgânicos e inorgânicos sais de ácido nítrico têm sido importantes historicamente como lojas de conveniência de energia química. Eles incluem compostos importantes, tais como nitrato de potássio (utilizado na pólvora ) e nitrato de amónio, um fertilizante e explosivos importante (ver ANFO). Vários outros compostos orgânicos nitrados, como o nitroglicerina, trinitrotolueno, e nitrocelulose, são utilizadas como explosivos e propulsores para as armas de fogo modernas. O ácido nítrico é utilizado como um agente oxidante em combustível líquido foguetes. Hidrazina e hidrazina derivados encontrar utilização como foguete combustíveis e monopropellants. Na maior parte destes compostos, a instabilidade de base e a tendência para arder ou explodir é derivada do facto de que o azoto está presente como um óxido, e não como a molécula de azoto muito mais estável (N 2), que é um produto dos compostos ' decomposição térmica. Quando nitratos queimar ou explodir, a formação da ligação tripla poderosa no N2 produz a maior parte da energia da reacção.
O nitrogênio é um componente de moléculas em cada grande classe de drogas em farmacologia e medicina. O óxido nitroso (N2O) foi descoberto no início do século 19 para ser um anestésico parcial, embora não tenha sido usado como um anestésico cirúrgico até mais tarde. Chamado " gás "rindo, verificou-se capazes de induzir um estado de embriaguez desinibição social, assemelhando-se. Outros medicamentos contendo nitrogênio notáveis são drogas derivadas de plantas alcalóides, tais como a morfina (existem muitos alcalóides conhecidos por terem efeitos farmacológicos e, em alguns casos, eles aparecem como defesas químicas naturais de plantas contra a predação). Os medicamentos que contêm azoto incluem todas as classes principais de antibióticos e drogas nitrato orgânico como e nitroglicerina nitroprussiato que regulam a pressão sanguínea e acção cardíaca, imitando a acção de óxido nítrico.
Papel biológico
O nitrogênio é um elemento essencial de amino e ácidos nucleicos, essencial para a vida na Terra.
Elementar azoto na atmosfera não pode ser utilizado directamente por plantas ou animais, e tem de ser convertido para um estado reduzido (ou "fixa") para ser útil para as plantas e animais superiores. Precipitação contém frequentemente quantidades substanciais de amónio e nitratos , que se pensa resultar da fixação de nitrogênio por raios e outros fenômenos elétricos atmosféricos. Isso foi proposto pela primeira vez por Liebig em 1827 e mais tarde confirmada. No entanto, porque amónio é preferencialmente retido pela dossel da floresta em relação ao nitrato atmosférica, mais nitrogênio fixado atinge o solo superficial debaixo de árvores como o nitrato. Nitrato no solo é preferencialmente assimilado por árvore raízes de amónio em relação ao solo.
Específicas bactérias (por exemplo, Rhizobium trifolium) possuem nitrogenase enzimas que podem fixam nitrogênio atmosférico (veja fixação de nitrogênio ) em um formulário ( ião de amónio), que é quimicamente útil para organismos superiores. Este processo requer uma grande quantidade de energia e condições anóxicas. Essas bactérias podem viver livremente no solo (por exemplo, Azotobacter), mas normalmente não existem numa relação simbiótica no nódulos radiculares de plantas leguminosas (por exemplo, trevo, Trifolium, ou soja planta, Glycine max ). Bactérias de fixação de nitrogênio também são simbiótica com um número de espécies de plantas não relacionados, tais como amieiros ( Alnus) spp., Líquenes, Casuarina, Myrica, hepáticas, e Gunnera.
Como parte da relação simbiótica, a planta converte o ião de amónio 'fixa' a óxidos de azoto e aminoácidos, para formar proteínas e outras moléculas, (por exemplo, alcalóides). Em troca do nitrogênio "fixo", a planta segrega açúcares para as bactérias simbióticas. Legumes manter um ambiente anaeróbico (oxigênio livre) para as suas bactérias fixadoras de nitrogênio.
As plantas são capazes de assimilar o azoto directamente sob a forma de nitratos que podem estar presentes no solo a partir de depósitos minerais naturais, fertilizantes artificiais, resíduos de origem animal, ou de decaimento orgânico (tal como o produto de bactérias, mas não bactérias especificamente associados com a planta). Nitratos absorvidos deste modo são convertidos em nitritos pela enzima nitrato-redutase, e, em seguida, convertido em amónia por uma outra enzima chamada nitrito redutase.
Compostos de azoto são blocos de construção básicos em biologia animal, bem. Os animais usam contendo nitrogênio aminoácidos de fontes vegetais como materiais de partida para todos os animais bioquímica em nitrogênio composto, incluindo o fabrico de proteínas e ácidos nucleicos. Insectos que se alimentam de plantas são dependentes de nitrogênio em sua dieta, de modo que variando a quantidade de fertilizante nitrogenado aplicado a uma planta pode afetar a taxa de reprodução de insetos que se alimentam de plantas adubadas.
Nitrato solúvel é um importante fator limitante para o crescimento de certas bactérias em águas oceânicas. Em muitos lugares do mundo, artificiais fertilizantes aplicados para recortar terras para aumentar a produtividade resultar na entrega de run-off de nitrogênio solúvel aos oceanos em bocas de rio. Este processo pode resultar numa eutrofização da água, como o crescimento bacteriano-driven nitrogênio esgota o oxigênio da água a tal ponto que todos os organismos superiores morrer. Bem conhecido áreas "zona morta" em os EUA Costa do Golfo e do Mar Negro são devido a este processo poluente importante.
Muitos peixes de água salgada fabricar grandes quantidades de óxido de trimetilamina a protegê-los contra a alta efeitos osmóticos de seu ambiente; conversão deste composto para dimetilamina é responsável pelo odor no início de peixes de água salgada unfresh. Em animais, radical livre óxido nítrico (NO) (derivado de um aminoácido ), serve como uma importante molécula reguladora para a circulação.
Reacção rápida de óxido nítrico em animais com água resulta na produção do seu metabolito nitrito. Animal metabolismo de azoto em proteínas, em geral, resulta em excreção de ureia , enquanto metabolismo animal de ácidos nucleicos resulta na excreção de ureia e ácido úrico. O odor característico de decaimento carne animal é causada pela criação de longa cadeia, contendo azoto, aminas , tal como putrescina e cadaverina, que são produtos de degradação dos aminoácidos e ornitina lisina, respectivamente, em decomposição de proteínas.
Decay de organismos e seus resíduos podem produzir pequenas quantidades de nitrato, mas a maioria decadência eventualmente retorna teor de nitrogênio para a atmosfera, como o nitrogênio molecular. A circulação de azoto da atmosfera, de compostos orgânicos, em seguida, de volta para a atmosfera, é referido como o ciclo de azoto .
Segurança
A libertação rápida de gás de azoto em um espaço fechado pode deslocar de oxigénio, e, portanto, representa um perigo de asfixia. Isso pode acontecer com alguns sintomas de alerta, uma vez que o ser humano corpo carotídeo é relativamente lento e um sistema de detecção de pobres com baixo oxigênio (hipóxia). Um exemplo ocorreu pouco antes do lançamento da primeira missão do vaivém espacial em 1981, quando dois técnicos perdeu a consciência (e um deles morreu) depois que entramos em um espaço localizado no Shuttle de Plataforma móvel Lançador que foi pressurizado com nitrogênio puro, como precaução contra incêndio. Os técnicos teria sido capaz de sair do quarto se eles tinham experimentado os sintomas iniciais de nitrogênio-respiração.
Quando inalado em alta pressões parciais (mais de cerca de 4 bar, encontrou em profundidades abaixo de cerca de 30 m em mergulho), azoto começa a agir como um agente anestésico. Ela pode causar narcose de azoto, um estado semi-anestesiado temporária de deficiência mental semelhante à causada pela óxido nitroso.
De azoto também se dissolve no gorduras na corrente sanguínea e no corpo. Descompressão rápida (em particular, no caso de mergulhadores ascendente demasiado depressa, ou demasiado rapidamente astronautas descompressão de pressão da cabina de pressão espacial) pode levar a uma condição potencialmente fatal chamada doença de descompressão (anteriormente conhecida como doença do caixão ou curvas), quando formar bolhas de nitrogênio no sangue, nervos, articulações e outras áreas sensíveis ou vitais. Outros gases "inertes" causar os mesmos efeitos de bolhas compostas por eles, então a substituição de nitrogênio na (aqueles outros que o dióxido de carbono e oxigênio gases) gases respiratórios podem impedir narcose por nitrogênio, mas não impede a doença de descompressão.
O contato direto da pele com azoto líquido irá causar grave congelamento ("queima" criogénicos). Isto pode acontecer quase instantaneamente em contacto, ou depois de um segundo ou mais, dependendo da forma de azoto líquido. Azoto líquido massa faz com que menos de congelamento rápido do que um spray de névoa nitrogênio (tal como é usado para congelar certos tumores de pele na prática da dermatologia). A área de superfície extra fornecido por materiais encharcada de nitrogênio também é importante, com a roupa encharcada ou algodão, causando danos muito mais rápido do que um derramamento de líquido direto com a pele. "Contato" total entre a pele nua e-gotas recolhidos ou piscinas de nitrogênio líquido grandes pode ser impedido por um segundo ou dois, por uma camada de isolamento de gás do efeito Leidenfrost. Isso pode dar à pele um segundo de proteção contra líquidos a granel de azoto. No entanto, nitrogênio líquido aplicado na pele em névoas, e em tecidos, ignora este efeito, e provoca queimaduras local imediatamente.
Os sensores de oxigênio são por vezes usados como uma precaução de segurança quando se trabalha com nitrogênio líquido para alertar os trabalhadores dos derrames de gás em um espaço confinado.
