
Césio
Informações de fundo
Os artigos desta seleção Escolas foram organizados por tópico currículo graças a voluntários Crianças SOS. Com SOS Children você pode escolher para patrocinar crianças em mais de cem países
| Césio | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
55 Cs | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||
ouro prateado  | ||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | césio, Cs, 55 | |||||||||||||||||||||||||||||||||
| Pronúncia | / s Eu z Eu ə m / VER -zee-əm | |||||||||||||||||||||||||||||||||
| Categoria Metallic | metal alcalino | |||||||||||||||||||||||||||||||||
| Grupo, período, bloco | (1) metais alcalinos , 6, s | |||||||||||||||||||||||||||||||||
| Peso atômico padrão | 132.9054519 (2) | |||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 6s 1 2, 8, 18, 18, 8, 1  | |||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||
| Descoberta | Robert Bunsen e Gustav Kirchhoff (1860) | |||||||||||||||||||||||||||||||||
| Primeiro isolamento | Carl Setterberg (1882) | |||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 1,93 g cm -3 · | |||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 1,843 g · cm -3 | |||||||||||||||||||||||||||||||||
| Ponto de fusão | 301,59 K , 28,44 ° C, 83,19 ° F | |||||||||||||||||||||||||||||||||
| Ponto de ebulição | 944 K, 671 ° C, 1240 ° F | |||||||||||||||||||||||||||||||||
| Ponto crítico | 1,938 K, 9,4 MPa | |||||||||||||||||||||||||||||||||
| Calor de fusão | 2.09 kJ mol -1 · | |||||||||||||||||||||||||||||||||
| Calor de vaporização | 63,9 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 32,210 J · · mol -1 K -1 | |||||||||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||
| Estados de oxidação | 1 (Fortemente óxido de base) | |||||||||||||||||||||||||||||||||
| Eletronegatividade | 0,79 (escala de Pauling) | |||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 375,7 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| 2: 2234,3 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| Terceira: 3400 kJ mol -1 · | ||||||||||||||||||||||||||||||||||
| Raio atômico | 265 pm | |||||||||||||||||||||||||||||||||
| O raio de covalência | 244 ± 23:00 | |||||||||||||||||||||||||||||||||
| Van der Waals raio | 343 pm | |||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbica de corpo centrado  | |||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | |||||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 205 Nco · m | |||||||||||||||||||||||||||||||||
| Condutividade térmica | 35,9 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) 97 uM · · K -1 m -1 | |||||||||||||||||||||||||||||||||
| O módulo de Young | 1,7 GPa | |||||||||||||||||||||||||||||||||
| Massa de módulo | 1,6 GPa | |||||||||||||||||||||||||||||||||
| Dureza de Mohs | 0,2 | |||||||||||||||||||||||||||||||||
| Dureza Brinell | 0,14 MPa | |||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-46-2 | |||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de césio | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
Césio ou césio é um elemento químico com o símbolo Cs e número atômico 55. É um prateado-ouro metal macio, alcalino, com um ponto de 28 ° C (82 ° F), o que o torna um dos apenas cinco metais elementares que são líquidos à fusão (ou quase) temperatura ambiente. O césio é um metal alcalino e tem propriedades físicas e químicas semelhantes às do rubídio e potássio . O metal é extremamente reactivo e pirofórico, que reage com água mesmo a -116 ° C (-177 ° F). É a menor elemento eletronegativo ter um isótopo estável, o césio-133. O césio é extraído principalmente de pollucite, enquanto o radioisótopos, especialmente césio-137, um produtos de cisão, são extraídos de resíduos produzidos por reatores nucleares.
Dois químicos alemães, Robert Bunsen e Gustav Kirchhoff, descobriu o césio em 1860 pelo método recém-desenvolvido de espectroscopia de chama. As primeiras aplicações de pequena escala para césio foram como um " getter "em tubos de vácuo e em células fotoelétricas. Em 1967, uma freqüência específica do espectro de emissão de césio-133 foi escolhida para ser usada na definição do segundo pelo Sistema Internacional de Unidades. Desde então, o césio tem sido amplamente utilizada em relógios atômicos.
Desde os anos 1990, a maior aplicação do elemento tem sido tão formato de césio para fluidos de perfuração. Ele tem uma gama de aplicações na produção de electricidade, em eletrônica e em química. O isótopo radioactivo de césio-137 tem uma meia-vida de cerca de 30 anos e é usada em aplicações médicas, industriais e medidores de hidrologia. Embora o elemento é apenas levemente tóxico, é um material perigoso como um metal e suas radioisótopos apresentam um risco elevado para a saúde se for libertada no ambiente.
Características
Propriedades físicas

O césio é um muito macio (que tem o menor dureza de todos os elementos, 0,2 Mohs), muito dúctil, de metal dourado pálido, que escurece na presença de quantidades vestigiais de oxigénio . Tem um ponto de fusão de 28,4 ° C (83,1 ° F), e é um dos poucos metais elementares que são líquidos nas proximidades temperatura ambiente. O mercúrio é o único metal elementar com um ponto de fusão mais baixo do que conhecido de césio. Além disso, o metal tem um bastante baixo ponto de ebulição , 641 ° C (1186 ° F), o mais baixo de todos os outros do que o mercúrio metais. Seus compostos queimar com uma cor azul ou violeta.

Formas césio ligas com outros metais alcalinos, bem como com ouro , e amálgamas com mercúrio. A temperaturas abaixo de 650 ° C (1202 ° F), que ligas com cobalto , ferro , molibdénio , níquel , platina , tântalo ou tungsténio . Ele forma bem definida compostos intermetálicos com antimónio , gálio , índio e tório , os quais são fotossensível. Mistura-se com os outros metais alcalinos (excepto com lítio), e a liga com um distribuição molar de 41% de césio, 47% de potássio , e 12% de sódio tem o ponto de fusão mais baixo de qualquer liga de metal conhecido, a -78 ° C (-108 ° F). Algumas amálgamas foram estudados: CSHG 2 é preto com um roxo metálico brilho, enquanto CSHG é de cor dourada, também com um brilho metálico.
Propriedades químicas
O césio é de metal altamente reactivo e muito pirofórico. Além inflamar espontaneamente no ar, ele reage explosivamente com água mesmo a baixas temperaturas, mais do que outros membros do primeiro grupo da tabela periódica . A reacção sólido com água ocorre a temperaturas tão baixas como -116 ° C (-177 ° F). Devido à sua elevada reactividade, o metal é classificado como um materiais perigosos. Ele é armazenado e transportado em seco hidrocarbonetos saturados, tais como óleo mineral. Da mesma forma, devem ser manuseados sob gás inerte tal como árgon . No entanto, uma explosão de césio-água é muitas vezes menos potente do que uma explosão -água de sódio com uma quantidade semelhante de sódio. Isso ocorre porque césio explode instantaneamente ao contato com a água, deixando pouco tempo para o hidrogênio a se acumular. Césio pode ser armazenado em vácuo selado vidro de borosilicato ampolas. Em quantidades de mais do que cerca de 100 gramas (3,5 oz), o césio é expedido em recipientes hermeticamente fechados, de aço inoxidável.
A química de césio é semelhante ao de outros metais alcalinos, mas é mais estreitamente semelhante ao de rubídio , o césio acima elemento na tabela periódica. Algumas pequenas diferenças resultam do facto de que ele tem uma maior massa atômica e é mais electropositivo do que outras (não radioactivos) de metais alcalinos. O césio é o elemento químico mais electropositive estável. O ião césio também é maior e menos "dura" do que as dos mais leves metais alcalinos .
Compostos

A grande maioria dos compostos de césio conter o elemento como o catião Cs +, que se liga ionicamente a uma ampla variedade de aniões . Uma exceção notável é fornecido pelo caeside anião (Cs -). Outras exceções incluem os vários subóxidos (ver secção sobre os óxidos abaixo).
Voltando-se a compostos mais normais, sais de Cs + são quase invariavelmente incolor, a menos que o próprio anião é colorida. Muitos dos sais simples são higroscópico, mas menos do que os correspondentes sais de metais alcalinos mais leves. O fosfato, acetato, carbonato , halogenetos, óxido, nitrato e sulfato são os sais solúveis em água. Sais duplos são muitas vezes menos solúvel, e à baixa solubilidade do sulfato de alumínio de césio é explorada na purificação de Cs a partir dos seus minérios. O sal duplo com antimônio (como CsSbCl 4), bismuto , cádmio , cobre , ferro e chumbo também são mal solúvel.
O hidróxido de césio (CsOH) é higroscópico e uma muito forte base. É rapidamente grava a superfície de semicondutores tais como silício . CsOH tenha sido previamente considerados pelos químicos como a "base forte", refletindo a atração relativamente fraca entre o grande Cs + íons e OH -.; é de facto o mais forte base de Arrhenius , mas um número de compostos que não podem existir em solução aquosa, tal como n-butil-lítio e amida de sódio, são mais básicas.
Uma mistura estequiométrica de césio e ouro vai reagir para formar auride césio.
Complexos
Como todos os cátions metálicos, Cs + formulários complexos com Lewis baseia em solução. Por causa de seu grande tamanho, Cs + geralmente adota números de coordenação superiores a coordenação de seis, o que é típico para os mais leves catiões de metais alcalinos. Esta tendência já é aparente pelo 8-coordenação em CsCl, vs o motivo halite adotada pelos outros cloretos de metais alcalinos. O seu número de coordenação e alta suavidade (tendência para formar ligações covalentes) são a base da separação de Cs + de outros catiões, como é praticado na recuperação de resíduos nucleares, onde 137 Cs + é separado a partir de grandes quantidades de não radioactivo K +.
Halides
De cloreto de césio (CsCl) cristaliza no simples sistema cristalino cúbico. Também chamado de "estrutura de cloreto de césio", este motivo estrutural é constituído por um rede cúbica primitivo com uma base de dois átomo, cada um com uma óctuplo coordenação; os átomos de cloro encontram-se sobre os pontos da rede nas extremidades do cubo, enquanto que os átomos de césio encontram-se nos furos no centro dos cubos. Esta estrutura é partilhada com CsBr e Csl, e muitos outros compostos que não contêm Cs. Em contraste, a maioria dos outros halogenetos alcalinos adoptar o cloreto de sódio estrutura (NaCl). A estrutura de CsCl é preferido porque tem uma Cs + raio iônico de 174 pm e Cl - 181 pm.
Óxidos
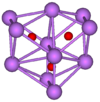
Mais do que os outros metais alcalinos, césio forma numerosos compostos binários com oxigênio . Quando césio queima no ar, a superóxido CSO 2 é o produto principal. O "normal" óxido de césio (Cs 2 O) forma amarelo-laranja cristais hexagonais, e é o único óxido do anti- CdCl2 tipo. É vaporiza a 250 ° C (482 ° F), e decompõe-se para metal de césio e o peróxido de Cs 2 O 2 a temperaturas superiores a 400 ° C (752 ° F). Além de o superóxido e o ozonido CSO 3, vários brilhantemente colorida subóxidos foram também estudados. Estes incluem Cs 7 O, 4 Cs O, Cs 11 O 3, 3 Cs O (verde-escuro), CSO, Cs 3 O 2, assim como Cs 7 O 2. Este último pode ser aquecida sob vácuo para produzir 2 O Cs. Compostos binários com enxofre , selênio e telúrio também existem.
Isótopos
O césio tem um total de 39 conhecidos isótopos que variam em sua número de massa (ou seja, número de nucleons em seu núcleo) de 112 para 151. Vários destes são sintetizados a partir de elementos mais leves por o processo de captura de neutrões lentos ( S-processo) dentro de estrelas antigas, bem como no interior de supernovas explosões ( R-processo). No entanto, a única estável isótopo é de 133 Cs, que tem 78 nêutrons . Embora tenha uma grande spin nuclear (02/07 +), estudos de ressonância magnética nuclear pode ser feito com este isótopo com uma frequência de ressonância de 11,7 MHz.

A radioativo 135 Cs tem uma meia-vida muito longa de cerca de 2,3 milhões anos, enquanto 137 Cs e 134 Cs têm meias-vidas de 30 e dois anos, respectivamente. 137Cs se decompõe a uma curta duração 137m Ba por decaimento beta, e em seguida, ao bário não radioactivo, enquanto 134 se transforma em 134 Cs Ba directamente. Os isótopos com números de massa de 129, 131, 132 e 136, com meias-vezes entre um dia e duas semanas, enquanto a maioria dos outros isótopos com meias-vidas de alguns segundos para frações de segundo. Há pelo menos 21 metaestável isómeros nucleares. Para além de 134m Cs (com uma semi-vida de um pouco menos de 3 horas), todos são muito instáveis e deterioração com meia-vida de alguns minutos ou menos.
O isótopo é um 135Cs do produtos de cisão de longa duração de urânio que formam em reatores nucleares. No entanto, a sua o rendimento do produto de fissão é reduzido na maior parte dos reatores porque seu antecessor, 135 Xe, é extremamente potente nêutrons veneno e transmuta com freqüência para estável 136 Xe antes que ele pode decair para 135 Cs.
Devido à sua decaimento beta (de 137m Ba), 137 Cs é um forte emissor de radiação gama. Sua meia-vida torna o principal produtos de cisão viveu a médio junto com 90 Sr-ambos são responsáveis por de radioactividade combustível nuclear após vários anos de arrefecimento até várias centenas de anos após o uso. Por exemplo 137 Cs, juntamente com 90 Sr geram atualmente a maior fonte de radioactividade gerada na área em torno do desastre de Chernobyl . Não é viável para dispor de 137 Cs através captura de neutrões (devido à baixa taxa de captura) e, como resultado, tem de ser autorizado a decair.
Quase todos césio produzidos por fissão nuclear vem decaimento beta de produtos de fissão originalmente mais ricos em nêutrons, passando por vários isótopos de iodo e de xenon. Porque iodo e xenon são voláteis e podem difundir através de combustível nuclear ou ar, césio radioativo é muitas vezes criado longe do local original da fissão. Com o início de testes de armas nucleares por volta de 1945, 137 Cs foi liberado para a atmosfera e, em seguida, voltou para a superfície da terra como um componente de precipitação radioativa.
Ocorrência

O césio é um elemento relativamente raro quanto se estima a média de aproximadamente 3 partes por milhão na Crosta da Terra. Isso torna o 45º mais abundante de todos os elementos ea 36 de todos os metais. No entanto, é mais abundante do que elementos tais como antimónio, cádmio, estanho e de tungsténio, e duas ordens de magnitude mais abundante do que o mercúrio ou prata , mas 3,3% tão abundantes como rubídio -com que é tão intimamente associado quimicamente.
Devido à sua grande raio iónico, o césio é um dos " elementos incompatíveis ". Durante magma cristalização, césio é concentrada na fase líquida e cristaliza passado. Portanto, os maiores depósitos de césio são zona corpos de minério pegmatite formadas por este processo de enriquecimento. Porque césio não substitui o potássio tão facilmente como faz rubídio, os minerais evaporíticos alcalinos silvite (KCl) e carnallite (KMgCl 3 · 6H 2 O) pode conter apenas 0,002% de césio. Consequentemente, Cs é encontrado em alguns minerais. Valores percentuais de césio pode ser encontrado em berilo (Be 3 Al 2 (SiO 3) 6) e avogadrite ((K, Cs) BF 4), até 15% em peso de Cs 2 O no mineral intimamente relacionado pezzottaite (Cs (2 Seja Li) Al 2 Si 6 O 18), até 8,4% em peso de Cs 2 O na mineral raro londonite ((Cs, K) Al 4 Be 4 (B, BE) 12 O 28), e menos no mais difundido rhodizite. O mineral fonte apenas economicamente importante para césio é pollucite Cs (AlSi 2 O 6), que é encontrado em poucos lugares do mundo em pegmatitos zoneadas, e está associada com as comercialmente mais importante de lítio minerais lepidolita e petalita. Dentro dos pegmatitos, o tamanho de grão grande e forte separação dos minerais criar minério de alta qualidade para a mineração.
Uma das fontes mais importantes e mais ricos do mundo do metal é o Tanco mina em Bernic Lake in Manitoba, Canadá. Os depósitos não são estimadas para conter 350.000 toneladas métricas de minério de pollucite, que representam mais de dois terços da base de reserva do mundo. Embora o teor de césio em estequiométrica pollucite é 42,6%, as amostras pollucite puras deste depósito conter somente cerca de 34% de césio, enquanto que o teor médio é de 24% em peso. Pollucite comercial contém mais de 19% de césio. O Bikita depósito de pegmatite em Zimbabwe é extraído para a sua petalite, mas também contém uma quantidade significativa de pollucite. Quantidades notáveis de pollucite também são minados na Karibib Desert, Namíbia . Ao ritmo actual de produção da mina mundial de 5 a 10 toneladas por ano, as reservas terão a duração de milhares de anos.
Produção
A mineração de minério de pollucite é um processo seletivo e é conduzida em uma escala pequena em comparação com a maioria das operações de mineração de metal. O minério é moído, mão-ordenadas, mas não normalmente concentrada, e então triturada. O césio é então extraído da pollucite principalmente por três métodos: digestão ácida, alcalina de decomposição, e de redução direta.
Na digestão de ácido, o silicato pollucite rocha é dissolvido com ácidos fortes, tais como clorídrico (HCl), sulfúrico (H 2 SO 4), bromídrico (HBr), ou (HF) ácidos fluorídrico. Com ácido clorídrico, uma mistura de cloretos solúveis é produzido, e o cloreto insolúvel sais duplos de césio são precipitados como cloreto de césio de antimónio (Cs 4 SbCl 7), cloreto de iodo de césio (Cs 2 ICl), ou de césio hexachlorocerate (Cs 2 (CeCl 6)). Após a separação, o sal duplo precipitado puro é decomposto, e CsCl puro é obtido após evaporação da água. O método que utiliza ácido sulfúrico produz o sal duplo insolúvel diretamente como césio alúmen (csal (SO4) 2 · 12H 2 O). O sulfato de alumínio em que é convertido para o insolúvel óxido de alumínio por ustulação do alúmen com carvão e o produto resultante é lixiviado com água para produzir uma solução de Cs 2 SO 4.
A torrefação de pollucite com carbonato de cálcio e cloreto de cálcio rendimentos silicatos de cálcio insolúvel e solúvel em cloreto de césio. A lixiviação com água ou diluir amoníaco (NH4OH) produz, em seguida, uma solução diluída de cloreto de (CsCl). Esta solução pode ser evaporada para produzir cloreto de césio ou transformado em alúmen de césio ou carbonato de césio. Embora não seja comercialmente viável redução, directa do minério com potássio, sódio ou cálcio em vácuo pode produzir metal de césio directamente.
A maior parte do césio extraído (como sais) é directamente convertida em césio formato (HCOO - Cs +) para aplicações como perfuração de petróleo. Para abastecer o mercado em desenvolvimento, Cabot Corporation construiu uma fábrica de produção em 1997 na mina Tanco perto Bernic Lake em Manitoba, com uma capacidade de 12.000 barris (1.900 m 3) por ano de solução de césio formato. Os compostos comerciais de menor porte primário de césio são cloreto de césio e a sua nitrato.
Alternativamente, metal de césio pode ser obtido a partir dos compostos purificadas derivadas a partir do minério. De cloreto de césio, e outros halogenetos de césio, bem como, pode ser reduzida a 700 a 800 ° C (1292 a 1472 ° F) com o cálcio ou o bário , seguido por destilação do metal de césio. Da mesma forma, o aluminato, carbonato, hidróxido ou pode ser reduzida por magnésio . O metal pode também ser isolado por meio de electrólise de césio fundido cianeto (CSCN). Excepcionalmente césio pura e livre de gás pode ser feita pela decomposição térmica a 390 ° C (734 ° F) de césio azida CSN 3, o qual é produzido a partir de sulfato de césio aquoso e azida de bário. Em aplicações de vácuo, césio dicromato pode ser feito reagir com zircónio puro formando metal de césio sem outros produtos gasosos.
- Cs 2 Cr 2 O 7 + 2 Zr → Cs 2 + 2 + ZrO 2 Cr 2 O 3
O preço de 99,8% de césio puro (elemento metálico) em 2009 foi de cerca de US $ 10 por grama (US $ 280 por onça), mas os seus compostos são significativamente mais barato.
História

Em 1860, Robert Bunsen e Gustav Kirchhoff descobriu césio na água mineral a partir de Dürkheim, Alemanha. Devido às linhas azuis brilhantes do seu espectro de emissão, eles escolheram um nome derivado da palavra caesius latim, que significa azul-celeste. O césio foi o primeiro elemento a ser descoberto espectroscopicamente , apenas um ano após a invenção do espectroscópio por Bunsen e Kirchhoff.
Para se obter uma amostra pura de césio, 44.000 litros (9.700 galões imp; 12.000 US gal) de água mineral teve de ser evaporado para se obter 240 kg (530 lb) de solução salina concentrada. Os metais alcalino-terrosos foram precipitadas quer como sulfatos ou oxalatos, deixando o metal alcalino na solução. Após a conversão para os nitratos e extracção com etanol , de uma mistura livre de sódio foi obtido. A partir desta mistura, o lítio foi precipitado pela carbonato de amónio. De potássio, rubídio e césio formam sais insolúveis com ácido cloroplatínico, mas estes sais mostram uma ligeira diferença na solubilidade em água quente. Portanto, o rubídio e césio menos solúvel hexacloroplatinato ((Cs, Rb) 2 PtCl 6) pode ser obtido por cristalização fraccionada. Após redução do hexacloroplatinato com hidrogénio , de césio e rubídio pode ser separado por a diferença em solubilidade dos seus carbonatos em álcool. O processo produziu 9,2 gramas (0,32 onças) de cloreto de rubídio e 7,3 gramas (0,26 onças) de cloreto de césio a partir de 44.000 litros iniciais de água mineral.
Os dois cientistas utilizado o cloreto de césio assim obtido para estimar o peso atômico do novo elemento em 123,35 (em comparação com o aceito atualmente um dos 132,9). Eles tentaram gerar césio elemental por eletrólise de cloreto de césio fundido, mas em vez de um metal, eles obtiveram uma substância homogénea azul, que "nem sob a olho nu nem sob o microscópio" mostrou o menor traço de substância metálica ", como resultado, eles atribuídos-lo como um subchloride (Cs Cl 2). Na realidade, o produto era provavelmente um mistura coloidal de o cloreto de metal e de césio. A electrólise da solução aquosa de cloreto de mercúrio com um ânodo produzido uma amálgama de césio que prontamente decomposta sob as condições aquosas. O metal puro foi finalmente isolada pelo químico alemão Carl Setterberg enquanto trabalhava em seu doutorado com Kekulé e de Bunsen. Em 1882, ele produziu metal de césio por electrólise cianeto de césio, e evitando, assim, os problemas com o cloreto.
Historicamente, o uso mais importante para o césio tem sido na pesquisa e desenvolvimento, principalmente nos campos químicos e elétricos. Muito poucas aplicações existiu por césio até a década de 1920, quando chegou a ser usado em rádio tubos a vácuo. Ele tinha duas funções; como uma getter, é removido o excesso de oxigénio após a produção, e como um revestimento na superfície aquecida cátodo, que aumentou a sua condutividade elétrica. Césio não se tornou reconhecido como um metal industrial de alto desempenho até 1950. Aplicações de césio não radioactivo incluído células fotoelétricas, tubos fotomultiplicadores, componentes ópticos de espectrofotómetros de infravermelhos, para vários catalisadores de reacções orgânicas, para cristais contadores de cintilação, e em geradores de energia magnetohidrodinâmicas.
Desde 1967, o Sistema Internacional de Medidas baseou a sua unidade de tempo, o segundo, sobre as propriedades de césio. O Sistema Internacional de Unidades (SI) define o segundo como 9192631770 ciclos do radiação, o que corresponde à transição entre dois hyperfine os níveis de energia do estado fundamental do césio-133 átomo . A 13ª Conferência Geral de Pesos e Medidas de 1967 definiu um segundo como: "a duração de 9192631770 ciclos de luz microondas absorvidos ou emitidos pela transição hiperfina de césio-133 átomos em seu estado fundamental não perturbadas por campos externos".
Aplicações
Exploração de petróleo
A maior utilização final atual de césio não radioativo está em baseado no formato de césio fluidos de perfuração para o indústria extrativa de petróleo. As soluções aquosas de césio formato (HCOO - Cs +) -que por reacção de hidróxido de césio com ácido fórmico -foram desenvolvido em meados da década de 1990 para uso como óleo de perfuração de poços e fluidos de completação. A função do formato de césio como um fluido de perfuração é a de lubrificar brocas, para trazer cortes de rocha para a superfície, e para manter a pressão sobre a formação, durante a perfuração do poço. Como fluido de conclusão, o que ajuda a colocação do hardware de controlo após a perfuração, mas antes da produção, a função do formato de césio é o de manter a pressão.
A elevada densidade da salmoura formiato de césio (até 2,3 g · cm -3, ou £ 19,2 por galão), juntamente com a natureza relativamente benigna da maioria dos compostos de césio, reduz a necessidade de sólidos de alta densidade tóxicos suspensos no fluido de perfuração -a significativa tecnológico, engenharia e vantagem ambiental. Ao contrário dos componentes de muitos outros líquidos pesados, césio formato é relativamente favorável ao meio ambiente. A salmoura de césio formiato podem ser misturados com os formatos de potássio e de sódio para diminuir a densidade dos fluidos para baixo para que a da água (1,0 g · cm-3, ou 8.3 libras por galão). Além disso, é biodegradável e recuperável, e pode ser reciclado, o que é importante, tendo em conta o seu custo elevado (cerca de $ 4,000 por barril em 2001). Formates alcalinos são seguros para lidar com e não danificar a formação ou produção de metais como os seus poços alternativos corrosivo, salmouras de alta densidade (como brometo de zinco ZnBr 2 soluções), às vezes fazem; eles também exigem menos custos de limpeza e eliminação.
Os relógios atômicos


Baseado césio- relógios atômicos observar transições eletromagnéticas no estrutura hiperfina de césio-133 átomos e usá-lo como um ponto de referência. O primeiro relógio de césio exato foi construída por Louis Essen em 1955 no Laboratório Nacional de Física do Reino Unido. Desde então, eles foram melhoradas várias vezes ao longo do último meio século, e formam a base para o tempo compatível com os padrões e medições de freqüência. Estes relógios frequência medida com um erro de 2-3 partes em 10 14, o que corresponderia a uma precisão de medida de tempo de 2 nanossegundos por dia, ou um segundo em 1400 mil anos. As versões mais recentes são precisas para melhor do que uma parte em 10 15, o que significa que eles estariam fora por cerca de 2 segundos desde a extinção dos dinossauros há 65 milhões de anos atrás, e tem sido considerada como "a realização mais precisa de uma unidade que a humanidade tem conseguido até hoje."
Relógios de césio também são usados em redes que supervisionam a temporização das transmissões de telefone celular e o fluxo de informação na Internet.
Energia elétrica e eletrônica
Vapor de césio geradores termiónicos são dispositivos de baixa potência que convertem energia térmica em energia elétrica. Nos dois eléctrodos Conversor tubo de vácuo, que neutraliza a carga espaço que se acumula perto do cátodo, e ao fazê-lo, aumenta o fluxo de corrente.
O césio é também importante para a sua Propriedades photoemissive pelo qual a energia luminosa é convertida em fluxo de elétrons. É utilizado em células fotoelétricas porque catodos à base de césio como o composto intermetálico K 2 CsSb têm baixa tensão limiar de emissão de elétrons . A gama de dispositivos photoemissive utilizando césio incluem dispositivos de reconhecimento de caracteres ópticos, fotomultiplicadoras, e Tubos de câmara de vídeo. No entanto, o germânio , o rubídio, o selênio, o silício, o telúrio, e vários outros elementos podem substituir césio em materiais fotossensíveis.
Iodeto de césio (CSI), brometo (CsBr) e fluoreto de césio (CSF) cristais são empregados para cintiladores em contadores de cintilação amplamente utilizado na exploração mineira e de investigação da física de partículas, uma vez que são bem adequadas para a detecção de gama e A radiação de raios-X. Césio, sendo um elemento pesado, oferece boa potência de frenagem, contribuindo para uma melhor detectivity. Compostos césio também pode fornecer uma resposta mais rápida (CSF) e ser menos higroscópico (CSI).
Vapor de césio é usado em muitos comum magnetômetros. O elemento também é usado como um padrão interno espectrofotometria. Tal como outros metais alcalinos , de césio tem uma grande afinidade para o oxigénio e é usado como um " getter "em tubos a vácuo. Outras utilizações incluem o metal de alta-energia laser , lâmpadas incandescentes de vapor e vapor retificadores.
Fluidos de centrifugação
Devido à sua elevada densidade, as soluções de cloreto de césio, sulfato de césio, e césio trifluoroacetato (Cs (O 2 CCF 3)) são comumente utilizados em biologia molecular para gradiente de densidade ultracentrifugação. Esta tecnologia é aplicada principalmente para o isolamento de partículas virais , subcelular organelas e frações, e Os ácidos nucleicos a partir de amostras biológicas.
Química e uso médico

Existem relativamente poucas aplicações de produtos químicos para césio. A dopagem com compostos de césio é utilizado para aumentar a eficácia de vários catalisadores de metal de iões usados na produção de produtos químicos, tais como ácido acrílico, antraquinona, óxido de etileno, metanol , anidrido ftálico, estireno, monómeros de metacrilato de metilo, e várias olefinas . É também usado na conversão catalítica de dióxido de enxofre em trióxido de enxofre na produção de ácido sulfúrico .
Fluoreto de césio goza de utilização nicho em química orgânica como um base, ou como um fonte de anidro ião fluoreto. Sais de césio por vezes substituir os sais de potássio ou de sódio em síntese orgânica, tal como ciclização, esterificao, e polimerização.
Aplicações nucleares e isotópicas
O césio-137 é muito comum radioisótopo utilizado como um gama-emissor em aplicações industriais. As suas vantagens incluem uma meia-vida de cerca de 30 anos, a sua disponibilidade a partir da ciclo do combustível nuclear, e tendo 137 Ba como produto final estável. A solubilidade de água de alta é uma desvantagem que o torna incompatível com grandes irradiadores de piscina para alimentos e suprimentos médicos. Tem sido usado na agricultura, tratamento do cancro, e o esterilização de alimentos, lamas de depuração, e equipamento cirúrgico. Radioativo isótopos de césio em dispositivos de radiação foram utilizados no campo médico para tratar determinados tipos de cancro, mas surgimento de alternativas melhores e a utilização de cloreto de césio solúvel em água presente nas fontes, o que poderia criar contaminação amplo, gradualmente colocar algumas destas fontes de césio usar. Césio-137 foi utilizado em uma variedade de calibres de medida industrial, incluindo a humidade, densidade, nivelamento, e calibres de espessura. Também tem sido utilizado em bem login dispositivos para medir a densidade de electrões das formações de rocha, o que é análogo à densidade a granel das formações.
Isótopos 137 também foi usado na hidrologia estudos análogos aos usando trítio. É um produto filho de reacções de cisão nuclear. Com o início dos testes nucleares por volta de 1945, e continuando até meados dos anos 1980, césio-137 foi lançado para a atmosfera, onde é absorvida rapidamente na solução. Conhecido variação ano-a-ano, nesse prazo, permite correlação com camadas de solo e sedimento. Césio-134, e em menor medida de césio-135, também têm sido utilizados em hidrologia como medida de produção de césio nas indústrias de energia nuclear. Enquanto eles são menos comuns do que qualquer um de césio-133 ou césio-137, estes isótopos têm a vantagem de serem produzidos exclusivamente a partir de fontes antropogênicas.
Outros usos

De césio e de mercúrio foram utilizados como um propulsor no início motores iônicos concebidos para propulsão de espaçonaves em longas missões interplanetárias ou extraplanetários. O método de ionização foi para retirar o elétron exterior do propulsor quando em contato com um de tungsténio eletrodo que tinha tensão aplicada. Preocupações sobre a acção corrosiva de césio em componentes da nave espacial ter empurrado o desenvolvimento no sentido do uso de propulsores de gases inertes, tais como xénon ; esta é mais fácil de manusear em testes baseados em terra e tem menos potencial para interferir com a sonda. Eventualmente, xénon foi usado na sonda experimental espaço profundo 1 lançada em 1998. No entanto, emissão de campo propulsores de propulsão eléctricos que utilizam um sistema simples de aceleração de iões de metal líquido, tal como de césio para criar pressão têm sido construídos.
Nitrato de césio é utilizado como oxidante e corante pirotécnica para queimar silício em infravermelhos chamas, tais como o alargamento LUU-19, porque emite grande parte da sua luz no espectro do infravermelho próximo. O césio foi usada para reduzir o assinatura de radar de plumas de escape no SR-71 Melro aviões militares. Césio, rubídio, juntamente com, foi adicionado como um carbonato de vidro porque isso reduz a condutividade eléctrica e melhora a estabilidade e durabilidade das fibras ópticas e dispositivos de visão nocturna. Fluoreto de césio ou fluoreto de césio de alumínio são usados nos fundentes formuladas para a brasagem de alumínio que contêm ligas de magnésio .
Prognostications
(MHD) sistemas de geração de energia magnetohidrodinâmicas foram pesquisados, mas não conseguiu ganhar aceitação generalizada. O césio metálico também tem sido considerado como o fluido de trabalho de alta temperatura em geradores de ciclo de Rankine turboelectric. Sais de césio foram avaliadas como reagentes antishock a ser utilizado após a administração de medicamentos arsenicais. Devido ao seu efeito sobre o ritmo cardíaco, no entanto, eles têm menos probabilidade de serem utilizados do que os sais de potássio ou de rubídio. Eles também têm sido usados para tratar a epilepsia .
Perigos para a saúde e segurança

Compostos césio são raramente encontradas pela maioria das pessoas, mas a maioria são levemente tóxicas por causa da semelhança química de césio para potássio . A exposição a grandes quantidades de compostos de césio pode causar hiperirritabilidade e espasmos, mas uma vez que tais quantidades não seriam normalmente encontradas em fontes naturais, césio não é um poluente ambiental importante produto químico. O dose letal (LD mediana 50 ) valor de cloreto de césio em murganhos é de 2,3 g por quilograma, a qual é comparável aos LD 50 valores de cloreto de potássio e cloreto de sódio .
| NFPA 704 |
|---|
 3 4 3 |
| O Sinal de perigo diamante fogo para metal de césio |
Césio metal é um dos elementos mais reativos e é altamente explosivo quando ele entra em contato com a água. O gás de hidrogénio produzido pela reacção é aquecida pela energia térmica libertada ao mesmo tempo, fazendo com que a ignição e uma violenta explosão. Isto pode ocorrer com outros metais alcalinos, mas césio é tão potente que esta reacção explosiva pode mesmo ser desencadeada por água fria. O temperatura de auto-ignição de césio é também -116 o C, por isso, é altamente pirofórico, e inflama-se explosivamente no ar para formar o hidróxido de césio e vários óxidos. O hidróxido de césio é uma muito forte base, e vai corroer rapidamente vidro.
Os isótopos 134 e 137 estão presentes na biosfera em pequenas quantidades a partir de atividades humanas e representam um fardo radioactividade que varia dependendo da localização. O césio radioactivo não se acumulam no organismo de forma tão eficaz como muitos outros produtos de fissão (tais como iodo radioactivo e radiostrontium). Cerca de 10% das lavagens césio absorvido para fora do corpo de forma relativamente rápida no suor e na urina. Os restantes 90% tem uma meia-vida entre 50 e 150 dias. Césio radioactivo segue potássio e tende a se acumular nos tecidos vegetais, incluindo frutas e legumes. Também está bem documentado que os cogumelos das florestas contaminadas acumular césio radioactivo (césio-137) em suas fúngicas sporocarps. Acúmulo de césio-137 em lagos tem sido uma grande preocupação após o desastre de Chernobyl . As experiências com cães mostraram que uma dose única de 3,8 milicuries (140 MBq, 4,1 ug de césio-137) por quilograma é letal dentro de três semanas; menores quantidades pode causar infertilidade e câncer. O Agência Internacional de Energia Atómica e de outras fontes alertaram que materiais radioativos, como césio-137, poderia ser utilizado em dispositivos de dispersão radiológica, ou " bombas sujas ".
