
Gadolínio
Informações de fundo
Esta seleção Escolas foi originalmente escolhido pelo SOS Children para as escolas no mundo em desenvolvimento sem acesso à internet. Ele está disponível como um download intranet. Crianças SOS tem cuidado de crianças na África por 40 anos. Você pode ajudar o seu trabalho na África ?
| Gadolínio | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
64 Gd | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||
branco prateado  | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | gadolínio, D'us, 64 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / ˌ ɡ æ d ə l ɪ n Eu ə m / GAD -ə- LIN -ee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | lantanídeos | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | n / D, 6, f | ||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 157,25 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 4f 7 5d 1 6s 2 2, 8, 18, 25, 9, 2 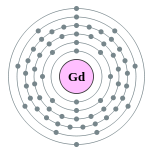 | ||||||||||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Jean Charles Galissard de Marignac (1880) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | Lecoq de Boisbaudran (1886) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 7,90 g cm -3 · | ||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 7,4 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1585 K , 1312 ° C, 2394 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 3546 K, 3273 ° C, 5923 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 10.05 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 301,3 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 37,03 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor (calculado) | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 1, 2, 3 (moderadamente óxido de base) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,20 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 593,4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Segunda: 1170 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 1990 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 180 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 196 ± 18:00 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | hexagonal repleto de perto | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | ferromagnético / paramagnético transição a 293,4 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | ( RT) (α, poli) 1,310 μΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 10,6 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | (100 ° C, α, poli) 9,4 uM / (mK) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 2.680 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | (Forma α) 54,8 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | (Forma α) 21,8 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | (Forma α) 37,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | (Forma α) 0,259 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Vickers | 570 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-54-2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de gadolínio | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
O gadolínio é um elemento químico com o símbolo Gd e número atómico 64. É um branco prateado, maleável e dúctil terras raras metal. Pode ser encontrada na natureza apenas em forma (sal) combinado. Gadolínio foi detectado pela primeira vez em 1880 por spectroscopically de Marignac que se separou do seu óxido e é creditado com sua descoberta. É nomeado para gadolinita, um dos minerais em que foi encontrado, por sua vez chamado para o químico Johan Gadolin. O metal foi isolado por Paul Emile Lecoq de Boisbaudran em 1886.
Gadolínio metálico possui incomuns metalúrgicos propriedades, na medida em que tão pouco quanto 1% de gadolinio pode melhorar significativamente a viabilidade e resistência a alta temperatura oxidação de ferro , crómio e afins ligas. Gadolínio como um metal ou sal tem excepcionalmente elevada absorção de neutrões e, portanto, é usado para a blindagem em neutrões radiografia e em reatores nucleares. Como a maioria das terras raras, gadolínio forma trivalentes iões que têm propriedades fluorescentes. Gd sais (III) que foram utilizados como fosforescentes verdes em várias aplicações.
O Gd (III), ião ocorrendo em sais solúveis em água é muito tóxico para os mamíferos. No entanto, quelatos de Gd (III) compostos são muito menos tóxicos porque transportam Gd (III) através dos rins e para fora do corpo antes de o ião livre pode ser libertado para o tecido. Devido à sua propriedades paramagnéticas, soluções de quelado orgânica gadolínio complexos são utilizados como administrado por via intravenosa agentes de contraste de MRI à base de gadolínio em médico ressonância magnética. No entanto, numa minoria de pacientes com insuficiência renal, pelo menos quatro de tais agentes têm sido associados com o desenvolvimento da doença inflamatória nodular rara nefrogénica fibrose sistêmica. Isto é pensado para ser devido ao ião de gadolínio em si, uma vez que as moléculas portadoras Gd (III) associados com a doença diferem.
Características

Propriedades físicas
O gadolínio é um branco prateado maleável e dúctil terras raras metal. Ele cristaliza em hexagonal, close-embalados forma α- à temperatura ambiente, mas, quando aquecido a temperaturas acima de 1235 ° C, ele se transforma em sua forma β-, que tem um corpo-estrutura cúbica centrada.
Gadolínio-157 tem a maior nêutrons térmicos capturar secção transversal entre quaisquer nuclídeos estáveis: 259.000 celeiros. Somente de xénon-135 tem uma secção transversal maior, 2.000.000 celeiros, mas que isótopo é instável.
Gadolínio é ferromagnético a temperaturas inferiores a 20 ° C (68 ° F) e é fortemente paramagnético acima dessa temperatura. Gadolínio demonstra um efeito magneto através do qual a sua temperatura aumenta quando entra num campo magnético diminui e quando sai do campo magnético. A temperatura baixou para (5 ° C (41 ° F)) para o gadolínio liga de Gd 85 Er 15, e o efeito é consideravelmente mais forte para a liga de Gd 5 ( Si 2 Ge 2), mas a uma temperatura muito mais baixa (<85 K (-188,2 ° C; -306,7 ° F)).
Átomos de gadolínio individuais foram isolados por encapsulando-os em moléculas de fulereno e visualizado com microscopia eletrônica de transmissão. Átomos de Gd individuais e pequenos grupos D'us também foram incorporadas nanotubos de carbono.
Propriedades químicas
Gadolínio combina com a maioria dos elementos, para formar os derivados de Gd (III). azoto, carbono, enxofre, fósforo, boro, selénio, silício e arsénio a temperaturas elevadas, formando compostos binários.
Ao contrário de outros metais de terras raras, gadolínio metálico é relativamente estável em ar seco. No entanto, ele mancha rapidamente no ar úmido, formando uma vagamente aderente óxido de gadolínio (III) (Gd 2 O 3), que spalls, expondo mais superfície à oxidação.
- 4 Gd + 3 O 2 → 2 Gd 2 O 3
Gadolínio é uma forte agente redutor, o que reduz os óxidos de vários metais nos seus elementos. Gadolínio é bastante electropositive e reage lentamente com água fria e muito rapidamente com água quente para formar hidróxido de gadolínio:
- 2 Gd + 6 H2O → 2 Gd (OH) 3 + 3 H 2
Gadolínio de metal é atacado prontamente por diluído ácido sulfúrico para formar soluções contendo o incolor Gd (III) íons, que existem como um [Gd (OH 2) 9] 3+ complexos:
- 2 Gd + 3 H 2 SO 4 + 18 H 2 O 2 → [Gd (H2O) 9] 3+ 3 + SO 4 2- + 3 H 2
Gadolínio de metal reage com os átomos de halogénio (X 2), a temperatura cerca de 200 ° C:
- 2 Gd + 3 X 2 → 2 3 GDX
Os compostos químicos
Na grande maioria dos seus compostos, Gd adopta o estado de oxidação +3. Todos os quatro trihaletos são conhecidos. Todos são brancos com excepção para o iodeto, o que é amarelo. Mais comumente encontrado de sais halogenados é gadolínio (III), cloreto de (GdCl 3). O óxido dissolve em ácidos para dar os sais, tais como nitrato de gadolínio (III).
Gadolínio (III), como a maioria dos iões lantanídeos, formas complexos com alta números de coordenação. Esta tendência está ilustrada pela utilização do agente quelante DOTA, um octa ligando denteado. Sais de [Gd (DOTA)] - são úteis em ressonância magnética. Uma variedade de complexos de quelatos relacionados têm sido desenvolvidos, incluindo gadodiamide.
Compostos de gadolínio reduzidas são conhecidos, especialmente no estado sólido. Halogenetos de gadolínio (II) são obtidos por aquecimento de halogenetos de Gd (III) na presença de Gd em recipientes metálicos de tântalo. Gadolínio também formar sesquicloreto Gd 2 Cl 3, que pode ser ainda mais reduzida para GdCl por recozimento a 800 ° C. Este gadolínio (I) de cloreto de formulários plaquetas com estrutura de grafite-como camadas.
Isótopos
Naturalmente que ocorre gadolínio é composta por 6 estáveis isótopos , 154 Gd, 155 Gd, 156 Gd, 157 Gd, 158 e 160 Gd D'us, e um radioisótopo, 152 D'us, com 158 Gd sendo o mais abundante (24,84% abundância natural). O decaimento beta duplo previsto de 160 Gd nunca foi observada (o único limite inferior sobre a sua meia-vida de mais de 1,3 x 10 21 anos tem sido definida experimentalmente).
Vinte e nove radioisótopos foram identificados, sendo os mais estáveis 152 Gd (que ocorre naturalmente), com uma meia-vida de 1,08 x 10 14 anos, e 150 Gd com uma meia-vida de 1,79 x 10 6 anos deteriorar-alfa. Todos os demais isótopos radioativos possuem meias-vidas de menos de 74,7 anos. A maioria destes com meias-vidas de menos do que 24,6 segundo. Isótopos gadolínio tem 4 metastable isômeros, com a 143m estar mais estável Gd (T ½ = 110 segundos), 145m Gd (T ½ = 85 segundos) e 141m Gd (T ½ = 24,5 segundo).
Isótopos com massas atómicas mais baixos do que o isótopo estável mais abundante, 158 Gd, principalmente decadência via captura de elétrons para a UE ( európio ) isótopos. Na massas atômicas maiores, o primário modo de decaimento é decaimento beta, e os produtos primários são Tb ( térbio ) isótopos.
História
O gadolínio é nomeado a partir do mineral gadolinite, por sua vez nomeado para Finlandês químico e geólogo Johan Gadolin. Em 1880, Swiss químico Jean Charles Galissard de Marignac observado linhas espectroscópicas devido ao gadolínio em amostras de gadolinita (que realmente contém relativamente pouco gadolínio, mas o suficiente para mostrar um espectro), e no mineral separado cerite. Este último mineral provou conter muito mais do elemento com a nova linha espectral, e Jean Charles Galissard de Marignac eventualmente separados um óxido mineral de cerite que ele percebeu foi o óxido de este novo elemento. Ele nomeou o óxido " gadolínia. "Porque ele percebeu que" gadolínia "foi o óxido de um novo elemento, ele é creditado com a descoberta de gadolínio. francês químico Paul Émile Lecoq de Boisbaudran efectivamente realizadas a separação de gadolínio metal do gadolínia, em 1886.
Ocorrência
Gadolínio é um constituinte em muitos minerais tais como monazita e bastnäsite, que são óxidos. O metal é muito reativa a existir naturalmente. Ironicamente, como notado acima, o mineral gadolinite realmente contém apenas vestígios de D'us. A abundância na crosta terrestre é de cerca de 6,2 mg / kg. As principais áreas de mineração são China, EUA, Brasil, Sri Lanka, Índia e Austrália, com reservas deverá ultrapassar um milhão de toneladas. A produção mundial de gadolínio puro é de cerca de 400 toneladas por ano.
Produção
Gadolínio é produzido a partir de ambos e monazite bastnäsite.
- Minerais esmagados são extraídos com clorídrico ou ácido sulfúrico , que converte os óxidos insolúveis em cloretos ou sulfatos solúveis.
- Os filtrados ácidos são parcialmente neutralizados com soda cáustica para um pH de 3-4. Tório precipita como hidróxido e é removido.
- A restante solução é tratada com oxalato de amónio para converter terras raras em que a sua insolúvel oxalatos. Os oxalatos são convertidos em óxidos por aquecimento.
- Os óxidos são dissolvidos em ácido nítrico que exclui um dos principais componentes, de cério , cujas óxido é insolúvel em HNO 3.
- A solução é tratada com nitrato de magnésio para produzir uma mistura cristalizada de sais duplos de gadolínio, samário e európio .
- Os sais são separados por cromatografia de permuta iónica.
- Os íons de terras raras são então lavados seletivamente pelo agente de complexação adequado.
Gadolínio metal é obtido a partir do seu óxido ou sais por aquecimento com cálcio a 1450 ° C sob atmosfera de árgon. Esponja de gadolinio pode ser produzido através da redução de 3 GdCl fundido com um metal apropriado a temperaturas inferiores a 1312 ° C (ponto de fusão de Gd) em uma pressão reduzida.
Aplicações
Gadolínio não tem aplicações em larga escala, mas tem uma variedade de usos especializados.
Gadolínio tem a secção transversal maior nêutrons entre quaisquer nuclídeos estáveis:. 61.000 celeiros para 155 Gd e 259.000 celeiros para 157 Gd 157 Gd tem sido usado para alvejar tumores em terapia de nêutrons. Este elemento é muito eficaz para o uso com A radiografia de nêutrons e na blindagem de reatores nucleares. É usado como uma medida de desligamento secundário, de emergência, em alguns reactores nucleares, particularmente do Tipo CANDU. Gadolínio, também é usado em sistemas de propulsão marítimos nucleares como um tóxico combustível.
Gadolínio também possui incomuns metalúrgicos propriedades, com tão pouco quanto 1% de gadolínio aumentar a exequibilidade e a resistência de ferro , crómio e afins ligas para altas temperaturas e oxidação.
Gadolínio é paramagnética à temperatura ambiente, com um ponto de Curie ferromagnético de 20 ° C. Iões paramagnéticos, tais como gadolínio, mover-se de forma diferente dentro de um campo magnético. Esta característica faz com gadolínio útil para imagens de ressonância magnética (MRI). Soluções de orgânico gadolínio e compostos complexos de gadolínio são utilizados como intravenoso Agente de contraste de MRI para melhorar as imagens em médico ressonância magnética e angiografia por ressonância magnética (MRA) procedimentos. Magnevist é o exemplo mais comum. Nanotubos embalados com gadolínio, apelidada de "gadonanotubes," são 40 vezes mais eficaz do que este agente de contraste gadolínio tradicional. Uma vez injectados, os agentes de contraste à base de gadolínio acumular em tecidos anormais do cérebro e do corpo. Esta acumulação proporciona um maior contraste entre tecidos normais e anormais, permitindo que os médicos para melhor localizar crescimentos celulares e tumores raros.
Gadolínio como um fósforo também é usado em outras imagens. Em Sistemas de Raios-X, o gadolínio está contido na camada de fósforo, suspensos numa matriz de polímero para o detector. Térbio - dopado oxissulfureto gadolínio (Gd 2 O 2 S: Tb) na camada de fósforo converte os raios X libertados a partir da fonte para a luz. Este material emite luz verde a 540 nm devido à presença de Tb 3+, que é muito útil para melhorar a qualidade de imagem. A conversão de energia de Gd é de até 20%, o que significa que um quinto dos raios-X que atingem a camada de fósforo pode ser convertido em fotões de luz. Oxyorthosilicate gadolínio (Gd 2 SiO 5, GSO, geralmente dopado por 0,1-1% de Ce ) é um único cristal que é utilizado como um cintilador na imagiologia médica, tais como A tomografia por emissão de pósitrons ou para a detecção de nêutrons.
Compostos de gadolínio também são usados para fazer verde fósforos para a cor TV tubos, e na fabricação de discos compactos .
Gadolínio-153 é produzido em um reator nuclear de európio elementar ou alvos gadolínio enriquecidos. Tem uma meia-vida de 240 ± 10 dias e emite radiação gama com fortes picos a 41 keV e 102 keV. Ele é usado em muitas aplicações de garantia da qualidade, tais como fontes de linha e fantasmas de calibração, para assegurar que sistemas de imagens de medicina nuclear operar corretamente e produzir imagens úteis de distribuição de radioisótopos dentro do paciente. É também usado como uma fonte de raios gama em medições de absorção de raios-X ou em medidores de densidade óssea para rastreio da osteoporose, bem como no sistema de imagem de raios-X portátil Lixiscope.
Gadolínio é utilizado para fazer gadolínio ítrio granada (Gd: Y 3 Al 5 O 12); tem aplicações de microondas e é utilizado na fabricação de diversos componentes ópticos e como material de substrato para filmes magneto-óptico.
Gadolínio gálio Garnet (GGG, Gd 3 Ga 5 O 12) foi utilizado para diamantes de imitação e para computador memória de bolha.
Papel biológico
Gadolínio não tem nenhum papel biológico nativo conhecida, mas seus compostos são usados como ferramentas de pesquisa em biomedicina. Compostos Gd 3+ são componentes de Agentes de contraste de MRI. Ele é utilizado em várias íon canal experimentos de eletrofisiologia para bloquear canais de vazamento de sódio e esticar os canais iônicos ativados.
Segurança
Como um ião livre, o gadolínio é relatada muitas vezes de ser altamente tóxico, mas são os agentes de contraste para IRM compostos quelatados e são considerados seguros o suficiente para ser usado na maioria das pessoas. Gadolínio livre iões toxicidade em animais é devido à interferência com um número de processos dependentes do canal de cálcio-ião. A dose letal de 50% é de cerca de 100-200 mg / kg. Toxicidades prolongados têm sido relatados após a exposição a uma dose baixa de íons do gadolínio. Os estudos de toxicidade em roedores, no entanto, mostram que a quelação de gadolínio (o que também melhora a sua solubilidade) diminui a sua toxicidade em relação ao ião livre por pelo menos um factor de 100 (isto é, a dose letal para os quelatos de Gd-aumenta 100 vezes) . Acredita-se, portanto, que a toxicidade clínica de agentes de contraste de Gd em seres humanos vai depender da intensidade do agente quelante; no entanto esta investigação ainda não está completa. Cerca de uma dúzia de diferentes agentes GD-quelatados foram aprovados como agentes de contraste de MRI em todo o mundo.
Os agentes de contraste de MRI gadolínio provaram ser mais seguros do que os agentes de contraste iodados utilizados na radiografia de raios-X ou tomografia computadorizada. Reacções anafilactóides são raros, ocorrendo em cerca de 0,03-0,1%.
Embora os agentes de gadolínio provaram ser úteis para doentes com insuficiência renal, em doentes com insuficiência renal grave com necessidade de diálise, há um risco de uma rara, mas grave, doenças, chamado A fibrose nefrogênica sistêmica (NSF) ou nephrogenic dermopatia fibrosante, que tem sido associada ao uso de quatro agentes de contraste com gadolínio. Os assemelha doença escleromixedema e até certo ponto esclerodermia. Pode ocorrer meses depois de contraste tenha sido injectado. A sua associação com gadolínio e não a molécula transportadora é confirmada pela sua ocorrência em contraste a partir de materiais em que o gadolínio é transportada por muito diferentes moléculas portadoras.
As diretrizes atuais no Estados Unidos são de que pacientes em diálise só deve receber os agentes de gadolínio onde essencial e para considerar a realização de um contraste iodado TC quando viável. Se um contraste de MRI reforçada deve ser realizada em um paciente de diálise, recomenda-se que certos agentes de contraste de alto risco ser evitado e que uma dose mais baixa ser considerado. O American College of Radiology recomenda que contraste aprimorado exames de RM ser realizada tão perto quanto possível antes de diálise como medida de precaução, embora isso não tenha sido comprovada a reduzir a probabilidade de desenvolvimento de NSF.

